题目内容
15.某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知该反应为放热反应,氧化性K2Cr2O7>Cl2,则下列说法不正确的是( )| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |
分析 某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H20,已知氧化性:K2Cr2O7>Cl2,则K2Cr2O7是氧化剂,Cl2是氧化产物,CrCl3是还原产物,由K元素守恒可知KCl为生成物,根据电子转移守恒可知HCl是反应物,由H元素守恒可知H2O是生成物,发生反应为K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,以此来解答.
解答 解:A、还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故A正确;
B、该反应是放热反应,盐酸挥发,所以每产生3mol Cl2,实际投入的盐酸要大于14mol,矿B正确;
C、Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故C正确;
D、当转移0.3mol电子时,被氧化的还原剂HCl的物质的量为$\frac{0.3mol}{1-0}$=0.3mol,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
5.对于可逆反应A(g)+3B(g)?2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=1mol/(L•s) | D. | υ(D)=2mol/(L•min) |
3.一定温度下已达化学平衡的反应:2X(g)+Y(g)═2Z(g),通过扩大容器体积来减小压强时,下列说法正确的是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
10.下列描述中正确的是( )
| A. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,可知CO的标准燃烧热为:566kJ•mol-1 | |
| B. | 含溶质0.5mol的浓硫酸和含溶质1mol的NaOH的稀溶液完全反应放出的热量为中和热 | |
| C. | 氯化钾中混有少量的硝酸钾,可用溶解、蒸发结晶、趁热过滤的方式来提纯氯化钾 | |
| D. | 淀粉和硫酸的混合溶液加热一段时间后,检验水解液中是否有淀粉时,可取少量水解液于试管中,加入足量的强氧化钠溶液处理,最后滴加少量碘水检验是否有淀粉 |
7.某混合溶液含CaCl2和Mg(HCO3)2,其浓度分别为2a mol•L-1和a mol•L-1,要求只用一种试剂将Mg2+、Ca2+除掉,应选用的试剂是( )
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
4.关于合金的叙述,不正确的是( )
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
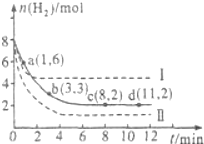 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇: ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.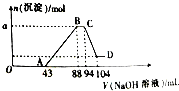 现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.