题目内容
11.下列表述正确的是( )| A. | H、D、T互为同素异形体 | B. | 中子数为20的氯原子: | ||
| C. | 四氯化碳的电子式: | D. | Cl-的结构示意图: |
分析 A.同素异形体是指同种元素组成的不同单质;
B.原子符号中左上角标注的是质量数,质量数=质子数+中子数;
C.四氯化碳的电子式中,氯原子的最外层达到8电子稳定结构,漏掉了氯原子的最外层3对未成键电子;
D.氯原子核电荷数为17,得到一个电子形成氯离子,据此画出离子结构示意图.
解答 解:A.H、D、T是氢元素的不同原子互为同位素,不是同素异形体,故A错误;
B.中子数为20的氯原子,氯元素的质子数为17,中子数为20的氯原子的质量数为37,该原子正确的表示方法为:1737Cl,故B错误;
C.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: ,故C错误;
,故C错误;
D.Cl-的质子数为17,电子数为18,Cl-结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查同位素、同素异形体、电子式书写、离子结构示意图的书写,题目难度不大,熟悉概念实质是解题的关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
1.在该有机物的结构中没有的官能团( )


| A. | 羟基 | B. | 醚键 | C. | 碳碳双键 | D. | 酯基 |
6.乙酸乙酯在KOH溶液中水解,得到的产物是( )
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醛 | D. | 乙酸 |
16.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是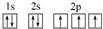 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是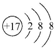 .
.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
 .
. 

 .
.
 .
. .
. .
. (写构简式)
(写构简式)