题目内容
19.按照要求写出下列反应方程式:(1)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体,其离子方程式是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(2)实验室通常用MnO2与浓盐酸反应制取氯气,其反应的离子方程式是MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;如有1molCl2生成,被氧化的HCl的物质的量是2mol,转移电子的物质的量是2mol;
(3)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑;
(4)氢氧化亚铁被空气里氧气氧化,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 (1)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体硅酸胶体和碳酸氢钠,其离子方程式是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(2)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,所以离子反应方程式为:MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,反应中消耗4mol氯化氢,只有2mol氯化氢中氯元素化合价升高,被氧化,氯元素由-1价升高到0价,所以如有1mol Cl2生成,被氧化的HCl的物质的量是2mol转移电子数为2mol;
(3)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为:2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑;
(4)氢氧化亚铁在氧气和水的作用下生成氢氧化铁,就是氢氧化亚铁与氧气和水发生反应的过程,据此写出化学方程式.
解答 解:(1)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体硅酸胶体和碳酸氢钠,其离子方程式是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(2)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,所以离子反应方程式为:MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,反应中消耗4mol氯化氢,只有2mol氯化氢中氯元素化合价升高,被氧化,氯元素由-1价升高到0价,所以如有1mol Cl2生成,被氧化的HCl的物质的量是2mol转移电子数为2mol,故答案为:MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,2,2;
(3)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为:2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑,故答案为:2Al+Ba(OH)2+2H2O=Ba(AlO2)2+3H2↑;
(4)氢氧化亚铁与氧气和水发生反应生成氢氧化铁,反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了氧化还原反应概念、离子方程式的计算,明确氧化还原反应规律是解题关键,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 凡是能起银镜反应的物质一定是醛 | |
| B. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 酯在过量氢氧化钠溶液中水解生成的最终产物为酸和醇 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
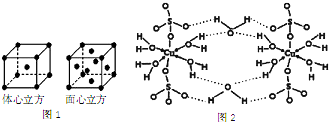
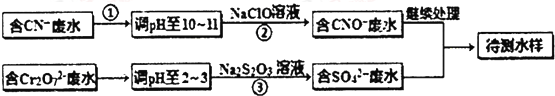
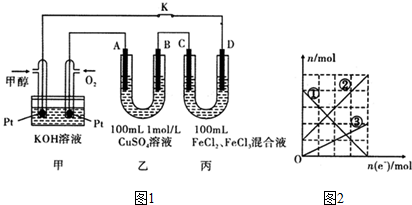


 六种物质中:
六种物质中: