题目内容
2.周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸.请回答下列问题: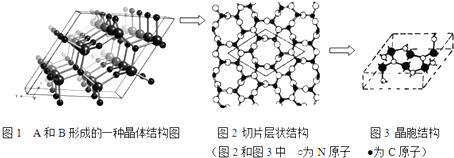
(1)C的基态原子的电子排布式为1s22s22p63s23p3;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是高氯酸中非羟基氧原子为3个,而氯酸中为2个(或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价对羟基氧原子吸引能力较弱).
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在.A、B、C都能与D形成中心原子杂化方式为sp3的两元共价化合物.其中,属于不等性杂化的是NCl3、PCl3(写化学式).以上不等性杂化的化合物价层电子对立体构型为四面体形,分子立体构型为三角锥形.
(3)以上不等性杂化化合物成键轨道的夹角小于(填“大于”、“等于”或“小于”)等性杂化的化合物成键轨道间的夹角.由于C核外比 B多一层电子,C还可以和D形成另一种两元共价化合物.此时C的杂化轨道中没有孤对电子,比起之前C和D的化合物,它的杂化轨道多了一条.其杂化方式为sp3d杂化.
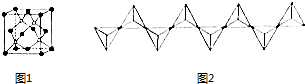
(4)A和B能形成多种结构的晶体.其中一种类似金刚石的结构,硬度比金刚石还大,是一种新型的超硬材料.其结构如图所示(图1为晶体结构,图2为切片层状结构),其化学式为C3N4.实验测得此晶体结构属于六方晶系,晶胞结构见图3.已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm.其晶体密度为3.11g.cm-3(结果精确到小数点后第2位.)
分析 周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍,原子L层电子数为4,故A为碳元素;B的价电子层中的未成对电子有3个,处于VA族,C与B同族,则B为N元素、C为P元素;D的最高价含氧酸为酸性最强的无机含氧酸,则D为Cl.
(1)C为P元素,原子核外电子数为15,根据能量最低原理书写核外电子排布;含氧酸中非羟基氧数目越多,中心元素化合价越高,酸性越强;
(2)C、N、P与Cl可以形成CCl4、NCl3、PCl3,中心原子均采取sp3杂化,NCl3、PCl3含有孤对电子,属于不等性杂化;
(3)孤对电子与成键电子对之间排斥大于成键电子对之间排斥;
由于P核外比N多一层电子,P还可以和Cl形成另一种两元共价化合物为PCl5,此时P的杂化轨道中没有孤对电子,与PCl3相比它的杂化轨道多了一条,则d轨道参与杂化,其杂化方式为sp3d杂化;
(4)碳和氮能形成多种结构的晶体.其中一种类似金刚石的结构,硬度比金刚石还大,属于原子晶体,
图2为切片层状结构中菱形内为层内重复结构单元,含有6个C原子、8个N原子,据此可以确定化学式;
实验测得此晶体结构属于六方晶系,晶胞结构图示原子都包含在晶胞内,计算晶胞质量、晶胞体积,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍,原子L层电子数为4,故A为碳元素;B的价电子层中的未成对电子有3个,处于VA族,C与B同族,则B为N元素、C为P元素;D的最高价含氧酸为酸性最强的无机含氧酸,则D为Cl.
(1)C为P元素,原子核外电子数为15,根据能量最低原理,核外电子排布为1s22s22p63s23p3;高氯酸中非羟基氧原子为3个,而氯酸中为2个(或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价对羟基氧原子吸引能力较弱),故高氯酸的酸性更强,
故答案为:1s22s22p63s23p3;高氯酸中非羟基氧原子为3个,而氯酸中为2个(或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价对羟基氧原子吸引能力较弱);
(2)C、N、P与Cl可以形成CCl4、NCl3、PCl3,中心原子均采取sp3杂化,NCl3、PCl3含,1孤对电子,属于不等性杂化,价层电子对数均为4,价层电子对立体构型为四面体形,分子立体构型为三角锥形,
故答案为:sp3;NCl3、PCl3;四面体形;三角锥形;
(3)孤对电子与成键电子对之间排斥大于成键电子对之间排斥,故不等性杂化化合物成键轨道的夹角小于等性杂化的化合物成键轨道间的夹角;
由于P核外比N多一层电子,P还可以和Cl形成另一种两元共价化合物为PCl5,此时P的杂化轨道中没有孤对电子,与PCl3相比它的杂化轨道多了一条,则d轨道参与杂化,其杂化方式为sp3d杂化,
故答案为:小于;sp3d杂化;
(4)碳和氮能形成多种结构的晶体.其中一种类似金刚石的结构,硬度比金刚石还大,属于原子晶体,图2为切片层状结构中菱形内为层内重复结构单元,含有6个C原子、8个N原子,C、N原子数目之比为3:4,则化学式为:C3N4,
实验测得此晶体结构属于六方晶系,晶胞结构图示原子都包含在晶胞内,晶胞质量=$\frac{6×12+8×14}{6.02×1{0}^{23}}$g,晶胞参数a=0.64nm,c=0.24nm,则晶胞体积为(0.64×10-7 cm)2×0.24×10-7 cm,故晶胞密度=
$\frac{6×12+8×14}{6.02×1{0}^{23}}$g÷[(0.64×10-7 cm)2×0.24×10-7 cm]=3.11g.cm-3,
故答案为:C3N4;3.11g.cm-3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、价层电子对互斥理论、杂化方式、分子结构与性质、晶胞计算等,(3)中涉及d轨道杂化,中学不涉及,(4)需要学生具备一个的空间想象与数学计算能力,题目难度较大.

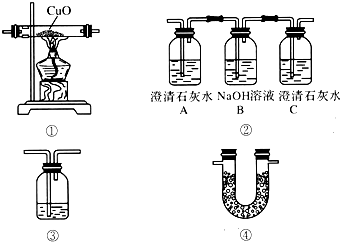
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |