题目内容
7.下列浓度关系正确的是( )| A. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-) | |
| D. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] |
分析 A.碳酸根离子水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CO32-);由于氢氧根离子还来自水的电离,则c(OH-)>c(HCO3-);
B.氯水呈酸性,氢氧根离子浓度小于次氯酸根离子;
C.反应后溶质为醋酸钠,醋酸根离子部分水解,导致醋酸根离子浓度减小;
D.氯水中,无法比较氯气分子与2[c(ClO-)+c(Cl-)+c(HClO)]的关系.
解答 解:A.Na2CO3溶液中,碳酸根离子水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CO32-),氢氧根离子还来自水的电离,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故A正确;
B.氯水中存在氯化氢和次氯酸,溶液呈酸性,氢氧根离子浓度最小,正确的离子浓度大小为:c(H+)>c(Cl-)>c(ClO-)>c(OH-),故B错误;
C.等体积等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠,醋酸根离子发生水解,则c(Na+)>c(CH3COO-),故C错误;
D.氯气与水部分反应生成氯化氢和次氯酸,发生反应的氯气满足n(Cl2)=2[n(ClO-)+n(Cl-)+n(HClO)],反应后溶液中不满足c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)],故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
9.CMU是一种荧光指示剂,可通过下列反应制备:
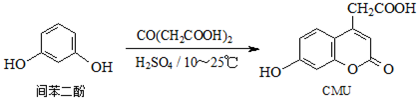
下列说法正确的是( )
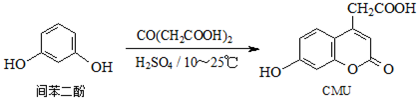
下列说法正确的是( )
| A. | 1molCMU最多可与1molBr2反应 | |
| B. | 1molCMU最多可与3molNaOH反应 | |
| C. | 可用FeCl3溶液鉴别间苯二酚和CMU | |
| D. | CMU在酸性条件下的水解产物只有1种 |
18.下列物质属于烃类的是( )
| A. | C2H5OH | B. | C3H8 | C. | CH3Br | D. | C6H5NO2 |
15.同温同压下,等质量的SO2与SO3相比较,下列叙述正确的( )
| A. | 分子个数比为4:5 | B. | 含硫元素质量比为4:5 | ||
| C. | 含氧原子个数比为5:6 | D. | 含硫原子个数比为5:6 |
2.下列指定溶液中一定能大量共存的离子组是( )
| A. | pH=1的溶液:NH4+、Fe3+、CO32-、SO42- | |
| B. | 含有大量AlO2-的溶液中:Fe2+、Cu2+、Cl-、Na+ | |
| C. | 中性溶液中:Fe3+、Al3+、Na+、K+、NO3- | |
| D. | Na2S溶液中:K+、NH4+、Cl-、SO42- |
19.下列说法正确的是( )
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 HA(一元酸)溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 常温下0.1 mol/L的下列溶液:①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| D. | 常温下0.4 mol/L HA溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,假设溶液体积可以相加,则混合溶液中离子浓度的大小顺序为c(A-)>c(H+)>c(Na+)>c(OH-) |
16.现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是( )
| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(H+)+c(HCN)=c(OH-) | D. | c(HCN)+c(CN-)=0.01mol/L |
5.下列化合物中含有共价键的是( )
| A. | HCl | B. | Na2O | C. | KBr | D. | MgCl2 |