题目内容
8.下列反应的离子方程式书写正确的是( )| A. | 钠和硫酸铜溶液反应:2Na+Cu2+═Cu2+2Na+ | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
分析 A.钠与硫酸铜溶液反应不会置换出金属铜;
B.石灰乳中的氢氧化钙不能拆开;
C.硫酸氢铵少量,铵根离子和氢离子都完全反应;
D.设溶液体积为1L,该溶液中含有1mol偏铝酸钠、2.5molHCl,1mol偏铝酸钠消耗1mol氢离子生成1mol氢氧化铝沉淀,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,据此进行判断.
解答 解:A.钠与硫酸铜溶液反应生成硫酸钠、氢气和氢氧化铜沉淀,正确的离子方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,故A错误;
B.工业上将Cl2通入石灰乳中制漂白粉,氢氧化钙不能拆开,正确的离子方程式为:Ca(OH)2+Cl2+═Cl-+ClO-+H2O+Ca2+,故B错误;
C.向Ba(OH)2溶液中加入少量的NH4HSO4溶液,铵根离子和氢离子都完全反应,正确的离子方程式为:Ba2++2OH-+H++NH4++SO42-═BaSO4↓+H2O+NH3•H2O,故C错误;
D.1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合,设溶液体积为1L,该溶液中含有1molNaAlO2、2.5molHCl,1molNaAlO2消耗1molHCl生成1molAl(OH)3沉淀,剩余的1.5molHCl能够溶解0.5molAl(OH)3,反应后生成铝离子与氢氧化铝的物质的量相等,反应的离子方程式为2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,正确判断过量情况对生成物影响为解答关键.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
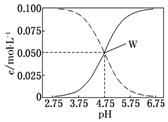 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
| A. | l mol OH-所含电子数为10NA | |
| B. | 2L0.5 mol•L-1Na2SO4溶液中阴离子所带电荷数为0.2NA | |
| C. | 标准状况下,1.12 L CC14含有的氯原子数为0.2NA | |
| D. | 14 g由CO和N2组成的混合气体中含有的分子总数为NA |
| A. | 反应中氯元素被氧化 | |
| B. | NaCN既是氧化剂又是还原剂 | |
| C. | 生成0.lmol N2,转移1mol电子 | |
| D. | 氧化产物与还原产物的物质的域之比为1:1 |
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| A. | 糖类、油脂、蛋白质均属于营养物质 | B. | 甲烷、乙醇、葡萄糖均属于有机物 | ||
| C. | NaOH与H2SO4均属于电解质 | D. | 纯碱、烧碱均属于碱 |
| A. | S2- | B. | Fe2+ | C. | SO32- | D. | K+ |
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(H+)=c(OH)+c(C2O42-) | |
| B. | 0.1mol•L-1的(NH4)2S溶液中:c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})•c(C{H}_{3}COOH)}$<1 | |
| D. | 等物质的量浓度,等体积的NaF溶液和HF溶液混合所得稀溶液中:c(H+)+c(HF)<c(F- )+2c(OH-) |