题目内容
下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A、①②③④ | B、①和③ |
| C、③和④ | D、①和④ |
考点:两性氧化物和两性氢氧化物
专题:元素及其化合物
分析:常见能和稀硫酸、氢氧化钠溶液反应的物质有:铝、两性氢氧化物、两性氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质,据此分析解答.
解答:
①NaHCO3是弱酸的酸式盐与硫酸反应生成硫酸钠、二氧化碳和水;与氢氧化钠反应生成碳酸钠和水,故①正确;
②Al2O3是两性氧化物,与硫酸反应生成硫酸铝和水;与氢氧化钠反应生成偏铝酸钠和水,故②正确;
③Al(OH)3是两性氢氧化物,与硫酸反应生成硫酸铝和水;与氢氧化钠反应生成偏铝酸钠和水,故③正确;
④Al与硫酸反应生成硫酸铝和氢气;与氢氧化钠反应生成偏铝酸钠和氢气,故④正确;
故选:A.
②Al2O3是两性氧化物,与硫酸反应生成硫酸铝和水;与氢氧化钠反应生成偏铝酸钠和水,故②正确;
③Al(OH)3是两性氢氧化物,与硫酸反应生成硫酸铝和水;与氢氧化钠反应生成偏铝酸钠和水,故③正确;
④Al与硫酸反应生成硫酸铝和氢气;与氢氧化钠反应生成偏铝酸钠和氢气,故④正确;
故选:A.
点评:本题以能和强酸、强碱反应的为载体考查了碱性氧化物、两性氧化物的判断,酸性氧化物能和碱反应、两性氧化物和强酸强碱都反应、碱性氧化物只和酸反应,据此分析解答,题目难度不大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
A、等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO
| ||||
| B、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
下列说法正确的是( )
| A、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B、7.8gNa2O2与CO2完全反应,转移0.1 mol电子 |
| C、合金中至少含有两种金属元素 |
| D、NaHCO3、CaCO3、(NH4)2CO3三种固体受热后均能生成气体 |
若需通过导电实验证明NaCl是离子化合物,可以选择的实验对象是( )
| A、NaCl固体 |
| B、NaCl水溶液 |
| C、NaCl熔融液 |
| D、以上都不可以 |
Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag.下列关于该电池的说法错误的是( )
| A、该电池工作时,正极反应为:2AgCl+2e一═2C1一+2Ag |
| B、镁电极做该电池负极,负极反应为:Mg-2e一═Mg2+ |
| C、有24g Mg被氧化时,可还原得到108gAg |
| D、装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O、MgO、Al2O3均属于碱性氧化物 |
| B、石灰石、生石灰、熟石灰均属于碱 |
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,18g H2O含有10nA个电子 |
| B、等物质的量的H2和N2所含分子数均为NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1L0.1mol/L NH4Cl 溶液中含有NH4+数目为0.1NA |
下列叙述中错误的是( )
| A、若将等量的硫蒸汽和硫固体分别完全燃烧,恢复到原状态,前者放出的热量多 |
| B、I2、SO3、固态氩都属于分子晶体 |
| C、1 molO2在反应中作氧化剂时,所得电子数一定为4NA |
| D、ag铁粉与含有H2SO4的CuSO4溶液恰好完全反应后,得到的固体为a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为2:7 |
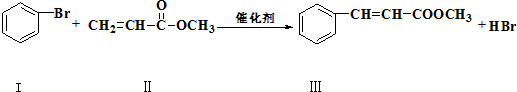

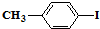 和
和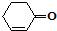 也可以发生类似如图的反应,有机产物的结构简式
也可以发生类似如图的反应,有机产物的结构简式