题目内容
10.下列离子方程式的书写正确的是( )| A. | 醋酸溶液与氨水混合:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 常温下C12与NaOH溶液反应:Cl2+2OH-═C1-+C1O-+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ |
分析 A.醋酸与氨水反应生成醋酸铵和水;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
D.漏掉了氢离子与氢氧根离子生成水的反应.
解答 解:A.醋酸溶液与氨水混合,二者反应生成醋酸铵和水,反应的离子方程式为:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O,故A正确;
B.铜片插入硝酸银溶液中,反应生成硝酸铜和银,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故B错误;
C.常温下C12与NaOH溶液反应的离子方程式为:Cl2+2OH-═C1-+C1O-+H2O,故C正确;
D.氢氧化钡与硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选AC.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
20.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
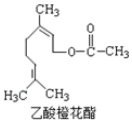

| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
1.下列离子方程式书写正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
18.下列离子方程式正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
15.一定温度下,反应2NO2(g)?N2O4(g)△H<0,在密闭容器中达到平衡状态. 下列说法中正确的是( )
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
2.锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如图(部分条件未给出).
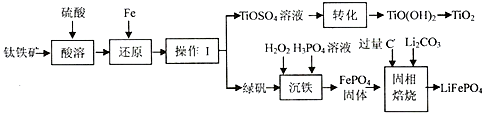
(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
则操作I 的名称为蒸发浓缩、冷却结晶、过滤.
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.

(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.
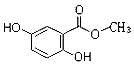
 .
.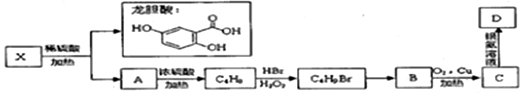
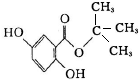 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.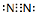 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.