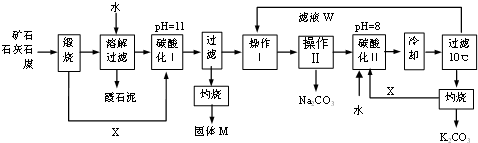
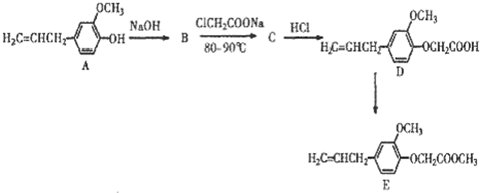
题目内容
下列物质中按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是( )
| A、F2 K HCl |
| B、Cl2 Al H2 |
| C、NO2 Na Br2 |
| D、O2 SO2 H2O |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由物质所含元素的化合价可知,如果物质所含元素处于中间价态,则物质既有氧化性又有还原性,处于最低价只有还原性,处于最高价只有氧化性,并结合物质的性质来解答.
解答:
解:A.F化合价只能降低,氟气只有氧化性,K化合价只能升高,所以金属钾只有还原性,HCl中H元素的化合价可降低,Cl元素的化合价可升高,如盐酸和金属反应表现氧化性,和高锰酸钾反应表现还原性,故A正确;
B.Cl2既有氧化性又有还原性,金属铝和氢气只有还原性,故B错误;
C.二氧化氮和水的反应说明二氧化氮既有氧化性又有还原性,金属钠只有还原性,溴单质既有氧化性又有还原性,故C错误;
D.二氧化硫中硫元素居于中间价,既有氧化性又有还原性,故D错误.
故选A.
B.Cl2既有氧化性又有还原性,金属铝和氢气只有还原性,故B错误;
C.二氧化氮和水的反应说明二氧化氮既有氧化性又有还原性,金属钠只有还原性,溴单质既有氧化性又有还原性,故C错误;
D.二氧化硫中硫元素居于中间价,既有氧化性又有还原性,故D错误.
故选A.
点评:本题考查氧化还原反应,为高频考点,把握元素的化合价与物质性质的关系为解答的关键,侧重氧化性、还原性判断的考查,题目难度不大.

练习册系列答案
相关题目
如图所示与对应的叙述相符的是( )


| A、图Ⅰ可表示对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 |
| B、图Ⅱ可表示体积都为1L,pH=2的盐酸和醋酸溶液分别与0.65g锌粒反应生成氢气速率的快慢 |
| C、图Ⅲ表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、p1<p2 |
| D、图Ⅳ可表示将等体积pH=2的盐酸和醋酸分别加水稀释过程中pH的变化 |
臭名昭著的三聚氰酸[C3N3(OH)3]却可用于消除汽车尾气中的NO2.其反应原理为:
C3N3(OH)3
3HNCO; 8HNCO+6NO2
7N2+8CO2+4H2O下列说法正确的是( )
C3N3(OH)3
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1molNO2在反应中转移的电子为4mol |
| D、CO2既不是氧化产物,也不是还原产物 |
下列有关生活中化学的叙述,不正确的是( )
| A、纯水和干木头都不导电,但木头用水浸湿后可以导电 |
| B、盛放碳酸钠溶液的试剂瓶不能用玻璃塞 |
| C、草木灰不能和铵态氮肥混合使用 |
| D、寻找高效催化剂,使水分解出产物氢气,同时释放能量 |
下列水解的离子方程式正确的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、Br-+H2O?HBr+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Fe3++3H2O?Fe(OH)3↓+3H+ |
安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )


| A、操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 |
| B、操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 |
| C、操作③:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水 |
| D、操作④:吸收氨气或氯化氢气体并防止倒吸 |