题目内容
如图所示与对应的叙述相符的是( )


| A、图Ⅰ可表示对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 |
| B、图Ⅱ可表示体积都为1L,pH=2的盐酸和醋酸溶液分别与0.65g锌粒反应生成氢气速率的快慢 |
| C、图Ⅲ表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、p1<p2 |
| D、图Ⅳ可表示将等体积pH=2的盐酸和醋酸分别加水稀释过程中pH的变化 |
考点:化学平衡的影响因素,化学反应速率的影响因素,弱电解质在水溶液中的电离平衡
专题:图示题
分析:A.在t1时缩小容器体积,增大了压强,平衡向着正向移动,与图象中v(逆)>v(正)不相符;
B.醋酸为弱酸,则醋酸的浓度大于盐酸,反应过程中醋酸会继续电离出氢离子,则醋酸与锌的反应速率大于盐酸的;
C.当温度一定时,增大压强平衡向气体体积减小的方向移动,当压强一定时,升高温度,平衡向吸热反应方向移动,根据温度、压强和二氧化氮的转化率的关系分析;
D.弱电解质溶液中存在电离平衡,加水稀释促进弱电解质电离.
B.醋酸为弱酸,则醋酸的浓度大于盐酸,反应过程中醋酸会继续电离出氢离子,则醋酸与锌的反应速率大于盐酸的;
C.当温度一定时,增大压强平衡向气体体积减小的方向移动,当压强一定时,升高温度,平衡向吸热反应方向移动,根据温度、压强和二氧化氮的转化率的关系分析;
D.弱电解质溶液中存在电离平衡,加水稀释促进弱电解质电离.
解答:
解:A.如果在t1时缩小容器体积,则增大了压强,平衡向着正向移动,v(逆)<v(正),与图象中v(逆)>v(正)不相符,故A错误;
B.反应开始氢离子浓度相同,反应速率相同,曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,故B错误;
C.当温度一定时,增大压强平衡向正反应方向移动,二氧化氮的转化率增大,则P1>P2,当压强一定时,升高温度,二氧化氮的转化率减小,则平衡向逆反应方向移动,则正反应是放热反应,△H<0,故C错误;
D.pH=2的盐酸和醋酸中,醋酸是弱电解质氯化氢是强电解质,所以醋酸的浓度大于盐酸,稀释相同的倍数,醋酸中氢离子浓度大于盐酸中氢离子浓度,所以醋酸的pH变化小于盐酸的变化,故D正确;
故选D.
B.反应开始氢离子浓度相同,反应速率相同,曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,故B错误;
C.当温度一定时,增大压强平衡向正反应方向移动,二氧化氮的转化率增大,则P1>P2,当压强一定时,升高温度,二氧化氮的转化率减小,则平衡向逆反应方向移动,则正反应是放热反应,△H<0,故C错误;
D.pH=2的盐酸和醋酸中,醋酸是弱电解质氯化氢是强电解质,所以醋酸的浓度大于盐酸,稀释相同的倍数,醋酸中氢离子浓度大于盐酸中氢离子浓度,所以醋酸的pH变化小于盐酸的变化,故D正确;
故选D.
点评:本题是图象分析题,题目难度中等,试题涉及弱电解质的电离、化学平衡、影响化学反应速率的因素等知识,明确图象中曲线的变化趋势、曲线的拐点是解本题关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列溶液中含Cl-物质的量浓度最大的是( )
| A、1mL 0.1mol?L-1的氯化铝溶液 |
| B、10mL 0.1mol?L-1的氯化钙溶液 |
| C、30mL 0.2mol?L-1的氯化钾溶液 |
| D、40mL 0.25mol?L-1的氯化钠溶液 |
下列物质中按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是( )
| A、F2 K HCl |
| B、Cl2 Al H2 |
| C、NO2 Na Br2 |
| D、O2 SO2 H2O |
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol?L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol?L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、M点时,溶液中沉淀的质量为3.9g |
| D、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.
为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验. 某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.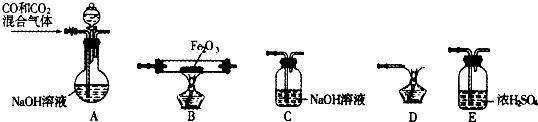
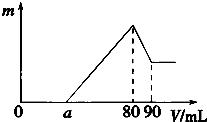 一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: