题目内容
4.下列递变规律不正确的是( )| A. | Na、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳态性依次减弱 |
分析 A.同周期从左向右金属性减弱;
B.第三周期从左向右最高正价增大;
C.同周期从左向右原子半径减小;
D.同主族从上到下非金属性减弱,非金属性越强,对应氢化物越稳定.
解答 解:A.同周期从左向右金属性减弱,则Na、Mg、Al原子的失电子能力逐渐减弱,故A正确;
B.第三周期从左向右最高正价增大,则Si、P、S元素的最高正化合价依次升高,故B错误;
C.同周期从左向右原子半径减小,则C、N、O的原子半径依次减小,故C正确;
D.同主族从上到下非金属性减弱,非金属性越强,对应氢化物越稳定,则Cl、Br、I的气态氢化物的稳态性依次减弱,故D正确;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
10.常温下,某溶液由水电离出的c(OH-)=1.0×10-13mol/L.对该溶液叙述正确的是( )
| A. | 溶液一定显酸性 | B. | 溶液一定显碱性 | ||
| C. | 溶液一定不显中性 | D. | 溶液可能显酸性.也可能显碱性 |
19.下列说法不正确的是( )
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
9.某物质在空气中燃烧的化学方程式为X+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O下列说法正确的是( )
| A. | X 的化学式是C2H4 | B. | 该反应属于置换 | ||
| C. | O 2中氧元素的化合价为-2 | D. | CO 2中碳、氧元素的质量比为 1:2 |
14.结合如图判断,下列叙述正确的是( )
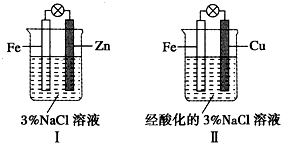

| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
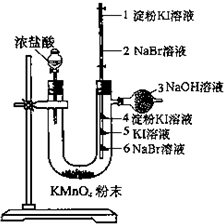 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化: