题目内容
10.常温下,某溶液由水电离出的c(OH-)=1.0×10-13mol/L.对该溶液叙述正确的是( )| A. | 溶液一定显酸性 | B. | 溶液一定显碱性 | ||
| C. | 溶液一定不显中性 | D. | 溶液可能显酸性.也可能显碱性 |
分析 常温下,某溶液中由水电离出的c(OH-)水=c(H+)水=1.0×10-13 mol/L<10-7mol/L,说明该溶液中的溶质抑制了水的电离;溶液中的溶质能电离出氢离子、氢氧根离子就能够抑制水电离,注意强碱弱酸盐或强酸弱碱盐能够促进水的电离,据此分析判断.
解答 解:由水电离出的c(OH-)水=c(H+)水=1.0×10-13 mol/L<10-7mol/L,说明溶液中的溶质抑制了水的电离,酸碱溶液抑制水的电离,水解的盐会促进水的电离,所以溶液一定不是中性,显酸性或碱性的盐会促进水的电离,抑制水的 电离是酸、碱的溶液,
故选C.
点评 本题考查了影响水的电离的因素,题目难度中等,注意掌握水的离子积,能够根据水电离的氢离子、氢氧根离子浓度判断水的电离程度,试题侧重对学生基础知识的训练和检验.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
1.下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 石灰石 | C. | 冰水 | D. | 矿泉水 |
18.关于同温、同压下等体积的CO2和CO的叙述,其中正确的是( )
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
5.下列说法不正确的是( )
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
| A. | 只有①⑤ | B. | ①②③ | C. | 全部 | D. | ①④⑤ |
15.一定温度下,某密闭容器中N2O5可发生下列反应:
①2N2O5(g)?4NO2(g)+O2(g)
②2NO2(g)?2NO(g)+O2(g)
若达到平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则NO(g)的浓度为( )
①2N2O5(g)?4NO2(g)+O2(g)
②2NO2(g)?2NO(g)+O2(g)
若达到平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则NO(g)的浓度为( )
| A. | 0.5mol•L-1 | B. | 0.6mol•L-1 | C. | 1.0mol•L-1 | D. | 1.6mol•L-1 |
7.(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIIA族.
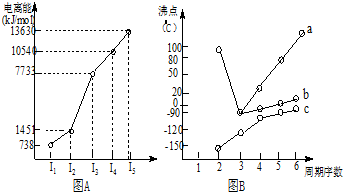
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.

II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 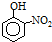 | 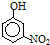 | 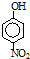 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.
4.下列递变规律不正确的是( )
| A. | Na、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳态性依次减弱 |

 +n HOCH2CH2OH
+n HOCH2CH2OH
 +(2n-1)H2O.
+(2n-1)H2O. .
. .
.