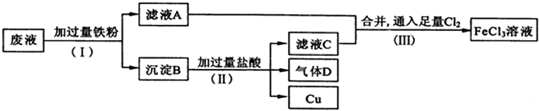
题目内容
16.3.6g H2O物质的量为0.2mol,约含有2NA个电子;与3.6g H2O所含H个数相同的CH4 的质量是1.6g,标准状况下体积约是2.24L.分析 求出水的物质的量n=$\frac{m}{M}$;然后根据水中含10个电子来分析;根据水中含2个H原子求出水中所含的氢原子的物质的量,从而求出含H原子个数相同的甲烷的物质的量,然后根据m=nM和V=nVm求出质量和体积,据此分析.
解答 解:水的物质的量n=$\frac{m}{M}$=$\frac{3.6g}{18g/mol}$=0.2mol,而水中含10个电子,故0.2mol水中含2mol电子即2NA个;而水中含2个H原子,故0.2mol水中含0.4mol氢原子,故含相同H原子个数的甲烷的物质的量为0.1mol,质量m=nM=0.1mol×16g/mol=1.6g,在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L.
故答案为:0.2;2NA;1.6g;2.24L.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 石灰石 | C. | 冰水 | D. | 矿泉水 |
7.(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIIA族.
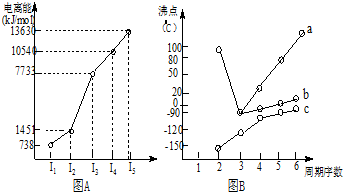
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.

II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 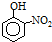 | 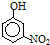 | 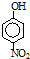 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.
4.下列递变规律不正确的是( )
| A. | Na、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳态性依次减弱 |
1.下列变化中,属于化学变化的是( )
| A. | 瓷碗破碎 | B. | 牛奶变酸 | C. | 轮胎爆炸 | D. | 冰雪融化 |
8.关于 1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )
| A. | 和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3 4.48L | |
| B. | 通入 H2S 气体,发生反应的离子方程式为:H2S+Fe2+=FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | Cl-、H+、I-、Na+不能在该溶液中大量共存 |
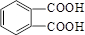 +n HOCH2CH2OH
+n HOCH2CH2OH
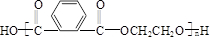 +(2n-1)H2O.
+(2n-1)H2O.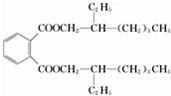 .
.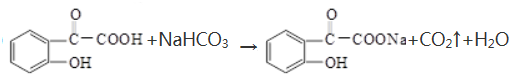 .
.