题目内容
12.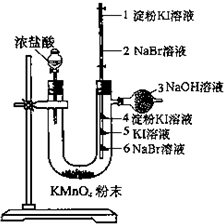 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:他向U形管中加入约2g高锰酸钾粉末;取一根长为5mm×150mm的玻璃管,插入橡皮塞中,在图所示装置中的“4、5、6”位置上贴滤纸小旗,分别滴3滴淀粉KI溶液、饱和KI溶液、溴化钠溶液.另取一同样的玻璃管,两端各塞入一小团脱脂棉,在1和2处脱脂棉上分别滴入淀粉KI溶液和饱和NaBr溶液,并在两端分别接一橡皮管(带夹子);在3处装入吸有NaOH溶液的脱脂棉,连接好装置.试回答下列问题:
当滴加浓盐酸到U形管后,即可看到有黄绿色的氯气产生,与小旗接触后,由下至上依次出现:黄色、棕褐色、蓝色.打开1、2处的夹子,当氯气恰好上升到2位置,保持一会儿即夹住2处,不使氯气上升.取下上节玻璃管,在2处微微加热,即看到红棕色的溴上升到1处,此时1处有蓝色出现.
分析 盐酸与高锰酸钾反应生成氯气,氯、溴、碘属于同主族元素,从上到下非金属性依次减弱,单质的氧化性依次减弱,结合溴水,碘水,碘遇淀粉的颜色解答.
解答 解:盐酸与高锰酸钾反应生成氯气,
氯气氧化性强于溴单质,所以氯气与溴化钠发生反应:Cl2+2NaBr=2NaCl+Br2,溴水显黄色;
氯气氧化性强于碘单质,所以氯气与碘化钾发生反应:Cl2+2KI=2KCl+I2,碘水显棕褐色;碘遇淀粉变蓝;
溴单质的氧化性强于碘单质,所以当打开1、2处的夹子,当氯气恰好上升到2位置,保持一会儿即夹住2处,不使氯气上升.取下上节玻璃管,在2处微微加热,即看到红棕色的溴上升到1处,溴单质与碘化钾发生反应:Br2+2KI=2KBr+I2,淀粉遇碘变蓝;
故答案为:黄;棕褐; 蓝;蓝.
点评 本题通过实验考查了卤素单质的性质,题目难度不大,明确卤素单质氧化性强弱的顺序是解题关键,注意同主族元素性质的递变规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.在pH=1溶液中能大量共存的是( )
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
18.关于同温、同压下等体积的CO2和CO的叙述,其中正确的是( )
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
15.一定温度下,某密闭容器中N2O5可发生下列反应:
①2N2O5(g)?4NO2(g)+O2(g)
②2NO2(g)?2NO(g)+O2(g)
若达到平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则NO(g)的浓度为( )
①2N2O5(g)?4NO2(g)+O2(g)
②2NO2(g)?2NO(g)+O2(g)
若达到平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则NO(g)的浓度为( )
| A. | 0.5mol•L-1 | B. | 0.6mol•L-1 | C. | 1.0mol•L-1 | D. | 1.6mol•L-1 |
7.(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIIA族.
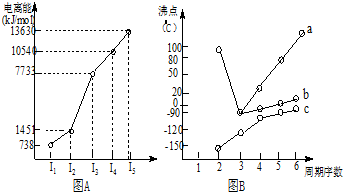
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.

II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 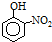 | 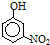 | 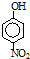 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.
4.下列递变规律不正确的是( )
| A. | Na、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳态性依次减弱 |
1.下列变化中,属于化学变化的是( )
| A. | 瓷碗破碎 | B. | 牛奶变酸 | C. | 轮胎爆炸 | D. | 冰雪融化 |
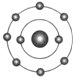 已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为.下列原子中,与氟元素原子的化学性质相似的是( )
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为.下列原子中,与氟元素原子的化学性质相似的是( )