题目内容
 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种①该溶液的焰色反应呈紫色
②取10mL该溶液于试管中滴加BaCl2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液又有白色沉淀产生.
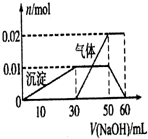
③另取10mL该溶液于试管中,滴加NaOH溶液,产生白色沉淀,当沉淀量产生到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解,并且随NaOH溶液的加入,沉淀和气体的变化关系如图所示:根据以上信息,回答下列问题:
(1)该溶液中一定含有
(2)实验中所用NaOH溶液的物质的量浓度
(3)分析该溶液中焰色反应呈紫色的离子物质的量浓度至少为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题,离子反应专题
分析:①某无色溶液一定不含Fe3+离子,根据焰色反应的颜色紫色判断K+的存在;
②取10mL该溶液于试管中滴加BaCl2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,生成沉淀为BaSO4,说明溶液中含有SO42-,根据离子共存,一定不存在Ba2+,向滤液中加入AgNO3溶液有沉淀产生,不能确定溶液中是否有Cl-,因加入了氯离子;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,说明溶液中含有NH4+,最后沉淀完全溶解.则说明溶液中含有Al3+;
(1)根据①②③分析解答;
(2)根据图象纵坐标可判断Al(OH)3和氨气的物质的量;根据Al(OH)3的两性可计算NaOH的浓度;
(3)根据该溶液中焰色反应呈现紫色的离子为K+,根据溶液呈电中性解答.
②取10mL该溶液于试管中滴加BaCl2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,生成沉淀为BaSO4,说明溶液中含有SO42-,根据离子共存,一定不存在Ba2+,向滤液中加入AgNO3溶液有沉淀产生,不能确定溶液中是否有Cl-,因加入了氯离子;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,说明溶液中含有NH4+,最后沉淀完全溶解.则说明溶液中含有Al3+;
(1)根据①②③分析解答;
(2)根据图象纵坐标可判断Al(OH)3和氨气的物质的量;根据Al(OH)3的两性可计算NaOH的浓度;
(3)根据该溶液中焰色反应呈现紫色的离子为K+,根据溶液呈电中性解答.
解答:
解:(1)①溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+离子;
②取10mL该溶液于试管中滴加BaCl2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,生成沉淀为BaSO4,说明溶液中含有SO42-,根据离子共存,一定不存在Ba2+,向滤液中加入AgNO3溶液有沉淀产生,不能确定溶液中是否有Cl-,因加入了氯离子;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,则说明溶液中含有Al3+,Al3++3OH-=Al(OH)3↓,结合图象中沉淀的变化关系,知溶液中含有Al3+为0.01mol需OH-为0.03mol;当沉淀增加到一定量后开始产生气体,根据NH4++OH-=NH3↑+H2O结合图象,知溶液中含有NH4+为0.02mol需OH-为0.02mol;最后沉淀完全溶解是由于氢氧化铝与NaOH继续反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,结合图象中沉淀的变化关系,需OH-为0.01mol;
故答案为:K+、NH4+、Al3+、SO42-;Fe3+;
(2)实验中使用的NaOH溶液的总物质的量为:0.03mol+0.02mol+0.01mol=0.06mol,结合图象中沉淀的变化关系知此时氢氧化钠溶液的体积为60mL,根据C=
=
=lmol/L,
故答案为:lmol/L;
(3)该溶液中焰色反应呈现紫色的离子为K+,该溶液中一定含有K+、NH4+、Al3+、SO42-;根据(1)③知NH4+为0.02mol,Al3+为0.01mol,SO42-为0.03mol,若无氯离子,根据溶液呈电中性溶液中阴阳离子所带的正负电荷总数相等,其中正电荷总数为:0.02mol×1+0.01mol×3+n(K+)×1=0.05mol+n(K+),负电荷总数0.03mol×2=0.06mol,所以n(K+)=0.01mol,根据C=
=
=lmol/L,若有氯离子,则钾离子浓度大于1mol/L;
故答案为:lmol/L;
②取10mL该溶液于试管中滴加BaCl2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,生成沉淀为BaSO4,说明溶液中含有SO42-,根据离子共存,一定不存在Ba2+,向滤液中加入AgNO3溶液有沉淀产生,不能确定溶液中是否有Cl-,因加入了氯离子;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,则说明溶液中含有Al3+,Al3++3OH-=Al(OH)3↓,结合图象中沉淀的变化关系,知溶液中含有Al3+为0.01mol需OH-为0.03mol;当沉淀增加到一定量后开始产生气体,根据NH4++OH-=NH3↑+H2O结合图象,知溶液中含有NH4+为0.02mol需OH-为0.02mol;最后沉淀完全溶解是由于氢氧化铝与NaOH继续反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,结合图象中沉淀的变化关系,需OH-为0.01mol;
故答案为:K+、NH4+、Al3+、SO42-;Fe3+;
(2)实验中使用的NaOH溶液的总物质的量为:0.03mol+0.02mol+0.01mol=0.06mol,结合图象中沉淀的变化关系知此时氢氧化钠溶液的体积为60mL,根据C=
| n |
| V |
| 0.06mol |
| 0.06L |
故答案为:lmol/L;
(3)该溶液中焰色反应呈现紫色的离子为K+,该溶液中一定含有K+、NH4+、Al3+、SO42-;根据(1)③知NH4+为0.02mol,Al3+为0.01mol,SO42-为0.03mol,若无氯离子,根据溶液呈电中性溶液中阴阳离子所带的正负电荷总数相等,其中正电荷总数为:0.02mol×1+0.01mol×3+n(K+)×1=0.05mol+n(K+),负电荷总数0.03mol×2=0.06mol,所以n(K+)=0.01mol,根据C=
| n |
| V |
| 0.01mol |
| 0.01L |
故答案为:lmol/L;
点评:本题考查离子的推断,根据题干提供的实验现象结合离子的性质进行推断,题目难度不大.注意加入的试剂引入的离子,易当作原试剂含有的离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
 如图是制取、干燥和收集某气体的实验装置,可用于( )
如图是制取、干燥和收集某气体的实验装置,可用于( )| A、用Zn与稀H2SO4反应制H2 |
| B、用CaO与浓氨水反应制NH3 |
| C、用Cu与稀HNO3反应制NO |
| D、用MnO2与浓HCl反应制C12 |
 X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.
X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.| A、①② | B、②③ | C、②④ | D、①④ |
下列实验方法或者实验操作叙述正确的是( )
| A、将pH试纸直接放在某溶液中,测试该溶液的pH |
| B、分液操作时,先将下层液体从下口放出,然后再换个烧杯将上层液体从下口放出 |
| C、过滤操作时,漏斗下端的尖嘴要紧靠烧杯的内壁 |
| D、用乙醇作萃取剂从碘水中提取碘 |
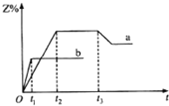 一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )
一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )| A、曲线b表示的是l00℃时的图象 |
| B、该反应的正反应是吸热反应 |
| C、t2时,曲线a、b对应反应速率v(a)>v(b) |
| D、t3时改变的条件可能是增大了压强 |
 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI