题目内容
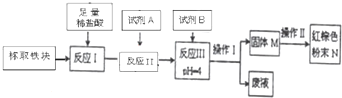
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.①写出所选用物质的化学式:A、
②写出烧瓶中发生反应的化学方程式:
③写出烧杯中发生反应的化学方程式:
④碳、氮、硅元素的非金属性强弱顺序为
考点:性质实验方案的设计
专题:
分析:利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答:
解:①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,A是硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,
故答案为:HNO3;CaCO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,
故答案为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;
④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,故答案为:氮>碳>硅.
故答案为:HNO3;CaCO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,
故答案为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;
④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,故答案为:氮>碳>硅.
点评:本题考查性质实验方案的设计,为高频考点,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,难度不大.

练习册系列答案
相关题目
下列各组物质中,第一种是酸,第二种是碱,第三种是的是混合物( )
| A、硫酸、CuSO4?5H2O、苛性钾 |
| B、硫酸、纯碱、空气 |
| C、氧化铁、胆矾、熟石灰 |
| D、硝酸、烧碱、食盐水 |
下列说法正确的是( )
| A、用氨水鉴别Al3+、Mg2+、Ag+ |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为血红色,该溶液中不一定含有Fe2+ |
| C、NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用烧碱溶液就可把它们鉴别开来 |
| D、要证明Fe3+溶液中含有Fe2+可以用NH4SCN溶液和氯水 |




 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)