题目内容
不影响H2O的电离平衡的粒子是( )
A、 |
B、 |
C、 |
D、 |
考点:盐类水解的应用,电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:酸或碱能抑制水电离,弱离子能促进水电离,据此分析解答.
解答:
解:A.氯化氢在水溶液里能电离出氢离子而抑制水电离,故A错误;
B.该离子为Al3+,铝离子为弱离子,能发生水解而促进水电离,故B错误;
C.该离子为Cl-,氯离子为强酸酸根离子,不能发生水解,所以不影响水电离,故C正确;
D.该离子为醋酸根离子,醋酸根离子为弱酸根离子,能发生水解而促进水电离,故D错误;
故选C.
B.该离子为Al3+,铝离子为弱离子,能发生水解而促进水电离,故B错误;
C.该离子为Cl-,氯离子为强酸酸根离子,不能发生水解,所以不影响水电离,故C正确;
D.该离子为醋酸根离子,醋酸根离子为弱酸根离子,能发生水解而促进水电离,故D错误;
故选C.
点评:本题考查了影响水电离的物质或离子,明确哪些物质或离子能促进或抑制水电离是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作符合要求的是( )
A、 定容 |
B、 收集氨水 |
C、 高温煅烧石灰石 |
D、 除去氯水中的氯化氢 |
 NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )| A、Pt电极作负极,NiO电极作正极 |
| B、Pt电极上发生的是氧化反应 |
| C、NiO电极上发生的是还原反应 |
| D、NiO电极的电极反应式为NO+O2--2e-═NO2 |
某无色透明的溶液能与铝反应放出氢气,此溶液中能大量共存的离子组是( )
| A、Ba2+、Cl-、NO3-、OH- |
| B、H+、Ba2+、Mg2+、SO42- |
| C、OH-、Na+、Mg2+、SO42- |
| D、Na+、K+、MnO4-、Cl- |
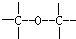 ④
④

 .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;