题目内容
 NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )| A、Pt电极作负极,NiO电极作正极 |
| B、Pt电极上发生的是氧化反应 |
| C、NiO电极上发生的是还原反应 |
| D、NiO电极的电极反应式为NO+O2--2e-═NO2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池工作时,阳离子向正极移动,阴离子向负极移动,由离子的定向移动可知NiO极为原电池的负极,Pt极为原电池的正极,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答:
解:A.由离子的定向移动可知NiO极为原电池的负极,Pt极为原电池的正极,故A错误;
B.Pt极为原电池的正极,正极发生还原反应,故B错误;
C.NiO极为原电池的负极,发生氧化反应,故C错误;
D.NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,故D正确.
故选D.
B.Pt极为原电池的正极,正极发生还原反应,故B错误;
C.NiO极为原电池的负极,发生氧化反应,故C错误;
D.NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,故D正确.
故选D.
点评:本题考查原电池知识,为高考常见题型和高频考点,注意把握原电池的工作原理,本题解答的关键是离子的定向移动,以此可确定电源的两极和反应类型,注意体会答题思路,难度中等.

练习册系列答案
相关题目
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温下,14g C2H4含有nA个氢原子 |
| B、1mol C和足量浓硫酸完全反应转移4nA个电子 |
| C、1L 0.1mol?L-1的Na2CO3溶液含有0.1nA个CO32- |
| D、标准状况下,22.4L CH3CH2OH含有个nA个CH3CH2OH分子 |
下列物质之间的相互关系错误的是( )
| A、CH3-CH2-NO2和N2H-CH2-COOH互为同分异构体 |
| B、O2和O3互为同素异形体 |
| C、CH3CH3和CH3CH3CH互为同系物 |
| D、干冰和冰为同一种物质 |
 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连.下列说法不正确的是( )
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连.下列说法不正确的是( )| A、若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液 |
| B、若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色 |
| C、若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol |
| D、若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol?L-1 |
下列说法正确的是( )
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 |
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量数值小于270 kJ |
| C、常温常压下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
不影响H2O的电离平衡的粒子是( )
A、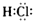 |
B、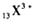 |
C、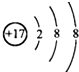 |
D、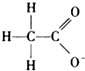 |
 一定温度下对冰醋酸逐滴加水稀释,发生如图变化,图中Y轴的含义可能是( )
一定温度下对冰醋酸逐滴加水稀释,发生如图变化,图中Y轴的含义可能是( )| A、导电能力 | B、pH |
| C、氢离子浓度 | D、溶液密度 |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.