题目内容
14.下列反应中,属于氧化还原反应又属于置换反应的是( )| A. | 3NO2+H2O=2HNO3+NO | B. | Cl2+H2O=HCl+HClO | ||
| C. | Na2O+H2O=2NaOH | D. | Fe+CuSO4=Cu+FeSO4 |
分析 置换反应是一种单质和一种化合物反应生成另一种单质和化合物的反应,所以置换反应一定有化合价变化,所以反应是氧化还原反应,由此分析解答.
解答 解;A、3NO2+H2O=2HNO3+NO不是置换反应,是氧化还原反应,故A错误;
B、Cl2+H2O=HCl+HClO不是置换反应,是氧化还原反应,故B错误;
C、Na2O+H2O=2NaOH是非氧化还原反应的化合反应,故C错误;
D、Fe+CuSO4=Cu+FeSO4是置换反应,是氧化还原反应,故D正确;
故选D.
点评 解答本题的关键是要充分理解反应类型的分类方法,只有这样才能对反应类型做出正确的判断.

练习册系列答案
相关题目
4.化学与环境保护、工业生产、生活等密切相关.下列说法正确的是( )
| A. | 用于制作集成电路板的酚醛树脂是天然高分子化合物 | |
| B. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
5.下列实验装置设计正确,且能达到目的是( )
| A. |  实验室制氨气 | B. |  测定盐酸浓度 | ||
| C. |  从食盐水中提取NaCl | D. |  石油的分馏 |
2.NA代表阿伏加德罗常数,以下叙述正确的是( )
| A. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| B. | 足量Cu和含4 mol HNO3的浓硝酸反应可生成2 NA个NO2分子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 在pH=13 的NaOH 溶液中,OH-的数目为0.1 NA |
9.乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
【装置】
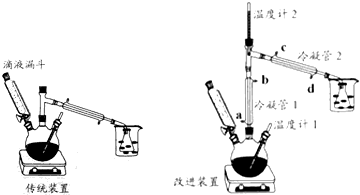
【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |

【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
19.下列选项中表达正确的是( )
| A. | Fe+CuSO4═FeSO4+Cu 氧化性Fe>Cu | |
| B. | Cl2+2KI═2KCl+I2氧化性Cl2>I2 | |
| C. | H2+CuO═Cu+H2O CuO是还原剂 | |
| D. | CaCO3+H2O+CO2═Ca(HCO3)2 是氧化还原反应 |
6.下列有关电池的叙述正确的是( )
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机用的锂离子电池属于一次电池 | |
| C. | 太阳能电池的主要材料为二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被还原 |
3.下列除去杂质的方法正确的是(括号内的是杂质)( )
| A. | N2(CO):通过灼热的CuO粉末 | B. | SO2 (HCl):通入饱和碳酸氢钠溶液中 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |