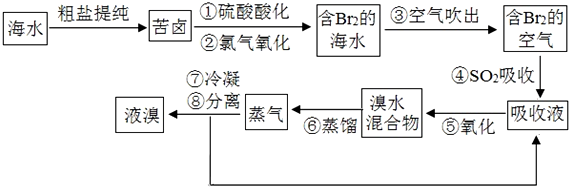
题目内容
4.现用质量分数为98%.密度为1.84g/ml的浓硫酸来配制500ml0.2mol/l的稀硫酸,可供选择的仪器如下;①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙 请回答下列问题.(1)上述仪器中,在配制稀硫酸时用不到的仪器有②⑦⑧(填序号)
(2)经计算,需浓硫酸的体积为5.4ml.现有①10ml.②50ml.③100ml三种规格的量筒,你选用的量筒是①(填序号)
(3)将浓硫酸稀释后,冷却片刻,随后全部转移到500ml的容量瓶中,转移时应用玻璃棒引流,转移完毕后,用少量蒸馏水洗涤烧杯玻璃棒2~3次,并将洗涤液也转入容量瓶中,在加适量蒸馏水直到液面接近刻线1~2cm处.改用胶头滴管滴加蒸馏水到瓶颈刻度的地方,将溶液振荡,摇匀后,装瓶,贴签.
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、容量瓶用蒸馏水洗涤后未干燥无影响;
B、所用的浓硫酸长时间放置在敞口容器内偏低;
C、定容时仰视溶液的凹液面偏低.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)配制500ml0.2mol/l的稀硫酸,需要用到500mL容量瓶,结合移液、定容的正确操作解答;
(4)依据配制一定物质的量浓度溶液的操作步骤判断;分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500ml容量瓶,所以用不到的仪器有烧瓶、托盘天平、药匙;
故答案为:②⑦⑧;
(2)质量分数98%密度为1.84g•cm-3浓H2SO4的物质的量浓度=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L;设需要浓硫酸溶液的体积为V,0.2mol•L-1×500ml=V×18.4mol/L,解得:V=5.4ml,应选择10ml量筒;
故答案为:5.4ml;①;
(3)将浓硫酸稀释后,冷却片刻,随后全部转移到500ml的容量瓶中,转移时应用玻璃棒引流,转移完毕后,用少量蒸馏水洗涤烧杯玻璃棒2~3次,并将洗涤液也转入容量瓶中,在加适量蒸馏水直到液面接近刻线1~~2cm处.改用胶头滴管滴加蒸馏水到瓶颈刻度的地方,将溶液振荡,摇匀后,装瓶,贴签;
故答案为;500;引流;1~2cm;胶头滴管;
(4)A、容量瓶用蒸馏水洗涤后未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响;
B、所用的浓硫酸长时间放置在敞口容器内,导致浓硫酸浓度降低,所取浓硫酸中含硫酸物质的量偏小,溶液浓度偏低;
C、定容时仰视溶液的凹液面,导致溶液体积偏大,溶液浓度偏低;
故答案为:无影响;偏低;偏低.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理和过程是解题关键,转移容量瓶的选择和使用注意事项,注意误差的分析.

| A. | 3NO2+H2O=2HNO3+NO | B. | Cl2+H2O=HCl+HClO | ||
| C. | Na2O+H2O=2NaOH | D. | Fe+CuSO4=Cu+FeSO4 |
| A. | 分液 | B. | 过滤 | C. | 蒸馏 | D. | 蒸发 |
| A. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne互为同位素 | B. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$Ne互为同素异形体 | ||
| C. | 具有相同的中子数 | D. | $\stackrel{20}{10}$Ne与羟基(-OH)所含电子数相等 |
| A. | 高锰酸钾溶液和双氧水的消毒原理相同,且使用时浓度不宜过大 | |
| B. | “低碳经济”主要是指减少对化石燃料的依赖 | |
| C. | 明矾和漂白粉可用于自来水的净化,但两者的作用原理不相同 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可使其消毒能力增强 |
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 三者的单质在空气中均能稳定存在 | |
| C. | 电解熔融状态的SiO2和Al2O3可以制得Si、Al,且都有氧气生成 | |
| D. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 |
 .
. .
. .
. .
. :
: