题目内容
17.下列说法不正确的是( )| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |
分析 A.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能;
B.指的是投入amolA和bmolB进行反应;
C.化学是一门研究物质的组成、结构、性质以及物质变化规律的科学;
D.甲烷分子中,1个2s轨道和3个2p轨道重新组合成4个sp3杂化轨道.
解答 解:A.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,即活化能指活化分子多出其它反应物分子的那部分能量,故A正确;
B.1mol的aA+bB=cC+dD反应,指的是投入amolA和bmolB进行反应,故B正确;
C.有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学,故C正确;
D.甲烷分子中,价层电子对个数=4+0=4,C原子中1个2s电子激发到2p后,1个2s轨道和3个2p轨道重新组合成4个sp3杂化轨道,分子构型正四面体形,故D错误.
故选D.
点评 本题考查活化能、热化学方程式、有机化学、原子杂化,根据价层电子对互斥理论确定分子空间构型及原子杂化方式的判断,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
8.已知,在25℃、101 kPa时:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
下列判断不正确的是( )
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
下列判断不正确的是( )
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
2.胶体区别于其它分散系的本质是( )
| A. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体的分散质粒子直径在1nm~100nm之间 |
9.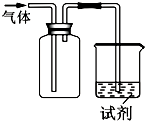 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
6.香烟燃烧产生的烟气中含有尼古丁(化学式C10H14N2)、焦油、一氧化碳等,下列说法中错误的是 ( 相对原子质量:C 12、H 1、N 14)( )
| A. | 尼古丁中C、H、N三种元素的质量比为5:7:1 | |
| B. | 吸烟有害健康 | |
| C. | CO比O2更易同血红蛋白结合,会导致人体缺氧 | |
| D. | 尼古丁中氮元素的质量分数约为17.3% |
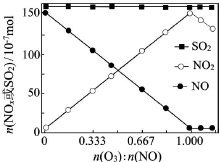 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: