题目内容
9.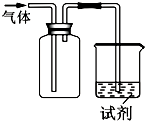 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NO是无色气体,难溶于水,不与水反应;
B.氯气的密度大于空气,氯气的氧化性大于碘单质;
C.SO2中+4价S具有还原性,能还原酸性KMnO4溶液,使其紫色褪去;
D.NH3密度比空气小,不能用如图所示的向上排空气法收集,氨气为碱性气体.
解答 解:A.NO是无色难溶于水的气体,密度比空气略大,且易与空气中的氧气反应,所以,不能用如图所示的向上排空气法收集,只能用排水法,NO不与水反应,所以不与紫色石蕊试液作用显红色,故A错误;
B.氯气是密度比空气大的气体,所以能用如图所示的向上排空气法收集,氯气能将碘单质从其盐中置换出来,Cl2+2I-═I2+2Cl-,所以氯气和碘化钠反应生成碘单质,可以看到溶液变蓝,说明氯气具有氧化性,故B正确;
C.SO2是密度比空气大的气体,所以,能用如图所示的向上排空气法收集,但SO2中+4价S具有还原性,与酸性KMnO4溶液发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4反应,导致酸性KMnO4溶液褪色,故C错误;
D.NH3密度比空气小,不能用如图所示的向上排空气法收集,氨气在水中存在平衡:NH3+H2O?NH3•H2O?NH4++OH-,在MgCl2溶液中产生白色沉淀为氢氧化镁,不是氨气有碱性,而是氨气与水反应产生碱,氨气是具有碱性的气体,故D错误;
故选B.
点评 本题考查实验方案的评价,题目难度不大,侧重于气体的收集和性质检验的考查,注意常见气体的收集方法,把握性质是解答的关键.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
20.下列说法正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
17.下列说法不正确的是( )
| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |
14.向0.1mol•L-1的H2SO4溶液中滴入0.1mol•L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下图为矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指( )

| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
18.能用组成元素的单质直接反应得到的物质是( )
| A. | NO 2 | B. | FeCl2 | C. | SO3 | D. | FeCl3 |
