题目内容
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA | |
| B. | 制取标准状况下22.4 L Cl2,需转移的电子数为2NA | |
| C. | 2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA | |
| D. | 标准状况下3.36 L HF里含有的原子总数为0.3NA |
分析 A、求出铁的物质的量,然后根据铁和水蒸汽反应后变为+$\frac{8}{3}$价来分析;
B、制取氯气的反应中,氯元素的价态变化不明确;
C、求出钠的物质的量,然后根据反应后钠元素为+1价来分析;
D、标况下HF为液态.
解答 解:A、5.6g铁的物质的量为n=$\frac{5.6g}{56g/mol}$=0.1mol,而铁和水蒸汽反应后变为+$\frac{8}{3}$价,故0.1mol铁失去$\frac{0.8}{3}$NA个电子,故A错误;
B、制取氯气的反应中,氯元素的价态变化不明确,故当生成1mol氯气时,转移的电子数无法计算,故B错误;
C、2.3g钠的物质的量为0.1mol,故反应后钠元素为+1价,故0.1mol钠失去0.1NA个,故C正确;
D、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量和原子个数,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
11.下列实验装置不能达到目的是( )
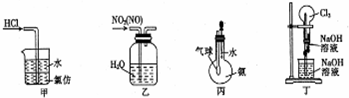

| A. | 装置甲:用于吸收HCl气体 | B. | 装置乙:用于除去NO2中的NO | ||
| C. | 装置丙:可验证氨气极易溶于水 | D. | 装置丁:可形成喷泉 |
12.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向NaClO溶液中滴加少量FeSO4溶液:5ClO-+2Fe2++5H2O═4HClO+Cl-+2Fe(OH)3↓ | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2 NH3•H2O═Cu(OH)2↓+2 NH4+ |
9.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可加NaOH溶液,振荡、静置、分液 |
16.下列给定条件的有机化合物的同分异构体数目正确的是
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 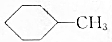 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
6.晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
13.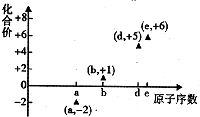 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
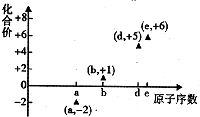 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 第一电离能d>e,电负性d<e | ||
| C. | 气态氢化物的稳定性:a>d>e | D. | a和b形成的化合物不可能含共价键 |
10.大多数有机物都能燃烧,目前人类活动所需要的能源中,化石燃料占有相当比重,请回答下列问题:
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
相同质量的上述四种物质,在标况下充分燃烧后,放出热量最多的是C2H6(写化学式).
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |