题目内容
11.0.1mol/L的HCl和0.1mol/L的CH3COOH溶液相比较,下列说法不正确的是( )| A. | 含H+的物质的量,盐酸大于醋酸 | |
| B. | 分别于锌反应,产生H2的物质的量不一定相等 | |
| C. | 分别于镁反应,反应速率盐酸大于醋酸 | |
| D. | H+的物质的量浓度,盐酸大于醋酸 |
分析 A.0.1mol/L的HCl和0.1mol/L的CH3COOH溶液浓度相同,溶液体积不知不能确定氢离子物质的量;
B.溶液体积不知,氢离子物质的量不确定不能判断生成氢气大小;
C.醋酸存在电离平衡,溶液中氢离子浓度小于盐酸,反应速率小;
D.醋酸存在电离平衡,氯化氢为强电解质完全电离.
解答 解:A.0.1mol/L的HCl和0.1mol/L的CH3COOH溶液相比较,溶液体积不知含H+的物质的量无法确定,故A错误;
B.溶液体积不知,氢离子物质的量不确定,分别与锌反应,产生H2的物质的量不一定相等,故B正确;
C.盐酸溶液中氢离子浓度大,与金属镁反应速率大,故C正确;
D.醋酸存在电离平衡,氯化氢为强电解质完全电离,H+的物质的量浓度,盐酸大于醋酸,故D正确;
故选A.
点评 本题考查了弱电解质电离平衡的影响因素、反应速率比较,主要是弱电解质电离平衡的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
2.下列离子方程式中正确的是( )
| A. | 碳酸钠加入醋酸溶液中:CO32-+2H+═H2O+CO2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | Ba(OH)2加入过量NaHCO3溶液中:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| D. | 铜粉投入FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ |
19.下列化学用语错误的是( )
| A. | 氯化氢分子的电子式: | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: |
16.下列化学反应表达错误的是( )
| A. | CH2=CH2+HBr $\stackrel{催化剂}{→}$CH3CH2Br | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5 | |
| C. | 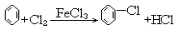 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
3.下列实验操作正确的是( )
| A. | 蒸发操作时,应将溶液完全蒸干后停止加热 | |
| B. | 稀释浓硫酸时,沿烧杯内壁将浓硫酸缓慢加入水中,边加边搅拌 | |
| C. | 分液操作时,先放出下层液体,再关闭活塞,从漏斗口倒出上层液体 | |
| D. | 配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管吸出多余液体 |
20.有关图的说法不正确的是( )
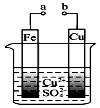

| A. | 构成原电池时Cu极反应为:Cu2++2e-=Cu | |
| B. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| C. | 要使Fe极不被腐蚀,Cu片换Zn片或将a与直流电源的负极相连 | |
| D. | a和b分别连接直流电源正、负极,Fe片上有气体产生 |
16.下列说法正确的是( )
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 分离胶体和某盐溶液,可用过滤的方法 | |
| D. | SO2、SiO2、CO均为酸性氧化物 |