题目内容
8.下列离子方程式正确的是( )| A. | SO2与酸性KMnO4溶液的反应:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| B. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.发生氧化还原反应,遵循电子、电荷守恒;
B.不符合离子的配比;
C.反应生成银氨溶液;
D.石灰水完全反应,生成碳酸钙、碳酸钠和水.
解答 解:A.SO2与酸性KMnO4溶液的反应的离子反应为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故A正确;
B.稀硫酸和氢氧化钡溶液反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.硝酸银溶液中滴加过量氨水的离子方程式为Ag++2NH3•H2O=Ag(NH3)2++2H2O,故C错误;
D.石灰水与过量碳酸氢钠溶液反应的离子反应为2HCO3-++Ca2++2OH-═CaCO3↓+CO32-+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
19.下列化学用语错误的是( )
| A. | 氯化氢分子的电子式: | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: |
16.下列化学反应表达错误的是( )
| A. | CH2=CH2+HBr $\stackrel{催化剂}{→}$CH3CH2Br | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5 | |
| C. | 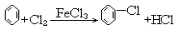 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
3.下列实验操作正确的是( )
| A. | 蒸发操作时,应将溶液完全蒸干后停止加热 | |
| B. | 稀释浓硫酸时,沿烧杯内壁将浓硫酸缓慢加入水中,边加边搅拌 | |
| C. | 分液操作时,先放出下层液体,再关闭活塞,从漏斗口倒出上层液体 | |
| D. | 配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管吸出多余液体 |
13.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
| A. | X、Y的转化率相等 | |
| B. | 在恒温恒压条件下,达到平衡后充入Y气体,则平衡正向移动 | |
| C. | 平衡时,Y和Z的生成速率之比为2:3 | |
| D. | c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
20.有关图的说法不正确的是( )
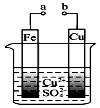

| A. | 构成原电池时Cu极反应为:Cu2++2e-=Cu | |
| B. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| C. | 要使Fe极不被腐蚀,Cu片换Zn片或将a与直流电源的负极相连 | |
| D. | a和b分别连接直流电源正、负极,Fe片上有气体产生 |
17.某溶液中只含有Na+、Fe3+、Cl-三种离子,其中Na+的物质的量为0.01mol,Fe3+的物质的量为0.04mol,在此溶液中加入0.03mol氢氧化钠,则最后溶液中的Na+与Cl-的数目之比为( )
| A. | 4:13 | B. | 1:13 | C. | 1:3 | D. | 13:4 |
13.下列有关化学用语表示正确的是( )
| A. | 乙醇的分子式:C2H5OH | B. | C的基态原子核外电子轨道表示式: | ||
| C. | 氯化铵的电子式: | D. | CS2分子比例(填充)模型: |