题目内容
6.已知:25℃时,Ksp( FeS)=6.3xl0-18;ksp( CuS)=1.3xl0-36;Ksp( ZnS)=1.6xl0-24.下列叙述正确的是( )| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
分析 由溶度积常数可知,溶度积越小,越难溶于水,越易生成沉淀,结合浓度对平衡移动的影响解答该题.
解答 解:A.由于Ksp(CuS)=1.3×10-36<Ksp(ZnS)=1.6×10-24<Ksp(FeS)=6.3×10-18,所以溶解度CuS<ZnS<FeS,故A错误;
B.ZnS饱和溶液中加入少量Na2S固体,c(S2-)增大,则c(Zn2+)减小,二者不等,故B错误;
C.由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂,故C正确;
D.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,溶度积最小的先沉淀,即Cu2+先沉淀出来,故D错误.
故选C.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意对溶度积常数的利用和理解.

练习册系列答案
相关题目
4.下列各组离子能大量共存的是( )
| A. | Na+、Mg2+、CO32-、I- | B. | H+、NO3-、Fe2+、Br- | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、S2-、Cu2+、SO32- |
5.锂电池反应原理如下:FePO4+Li$?_{充电}^{放电}$LiFePO4,内部为能够导电的固体电解质.下列有关该电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
2.下列有关双氧水跟酸性高锰酸钾反应的方程式正确的是( )
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
11.滴定实验是化学学科中重要的定量实验.请回答下列问题:
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作会造成测定结果偏高的是CD(填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A.用碱式滴定管取稀NaOH溶液25.00mL,注入锥形瓶中,加入甲基橙作指剂
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以 上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写)ECBADGF;
b.在G操作中如何确定滴定终点?当滴进最后一滴溶液由黄色变橙色,且半分钟内不变色.
(2)氧化还原滴定:取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+22MnSO4+8H2O,表格记录了实验数据:
①滴定时,KMnO4溶液应装在酸(“酸”或“碱”)式滴定管中,达终点时的现象是锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色.
②该草酸溶液的物质的量浓度为0.2mol/L.
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作会造成测定结果偏高的是CD(填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A.用碱式滴定管取稀NaOH溶液25.00mL,注入锥形瓶中,加入甲基橙作指剂
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以 上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写)ECBADGF;
b.在G操作中如何确定滴定终点?当滴进最后一滴溶液由黄色变橙色,且半分钟内不变色.
(2)氧化还原滴定:取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+22MnSO4+8H2O,表格记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2mol/L.
18.现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
15. 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)B、D、C、E、A、F;
(2)上述B步骤操作的目的是防止滴定管内壁的水将标准液稀释;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是增大.(填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为酚酞试液,判断到达滴定终点的实验现象是:当滴入最后一滴溶液时,锥形瓶中溶液有无色变为浅红色,且半分钟不褪色;
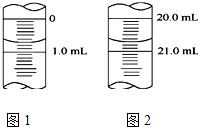
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为0.70mL,图2为滴定结束液面,则本次滴定过程共使用了20.00mLKOH标准溶液
(6)为标定某醋酸溶液的准确浓度,用0.1000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.1000mol•L-1.(保留小数点后四位)
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)B、D、C、E、A、F;
(2)上述B步骤操作的目的是防止滴定管内壁的水将标准液稀释;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是增大.(填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为酚酞试液,判断到达滴定终点的实验现象是:当滴入最后一滴溶液时,锥形瓶中溶液有无色变为浅红色,且半分钟不褪色;
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为0.70mL,图2为滴定结束液面,则本次滴定过程共使用了20.00mLKOH标准溶液
(6)为标定某醋酸溶液的准确浓度,用0.1000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
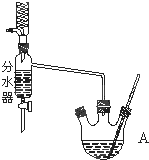
16. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,继续滴加至液溴滴完.
①写出实验室合成溴苯的化学方程式C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
②装置c的作用是使溴和苯冷凝回流;
③装置d的作用是吸收HBr和Br2;
④用胶头滴管从d中吸取少量溶液于试管中加入硝酸酸化,再滴加硝酸银溶液,有浅黄色沉淀生成,能否证明a中发生了取代反应?为什么?不能.因Br2与NaOH反应生成的Br-会与Ag+结合生成浅黄色沉淀.
(2)当液溴滴加完成后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.用NaOH溶液洗涤的作用是除去HBr和未反应的Br2.
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是除去粗溴苯中的水.
(3)经以上分离操作后,粗溴苯中还含有杂质要进一步提纯,下列操作中必须的是C(填字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,继续滴加至液溴滴完.
①写出实验室合成溴苯的化学方程式C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
②装置c的作用是使溴和苯冷凝回流;
③装置d的作用是吸收HBr和Br2;
④用胶头滴管从d中吸取少量溶液于试管中加入硝酸酸化,再滴加硝酸银溶液,有浅黄色沉淀生成,能否证明a中发生了取代反应?为什么?不能.因Br2与NaOH反应生成的Br-会与Ag+结合生成浅黄色沉淀.
(2)当液溴滴加完成后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.用NaOH溶液洗涤的作用是除去HBr和未反应的Br2.
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是除去粗溴苯中的水.
(3)经以上分离操作后,粗溴苯中还含有杂质要进一步提纯,下列操作中必须的是C(填字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(字母).
A.25mL B.50mL C.250mL D.500mL.
 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.