题目内容
 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式
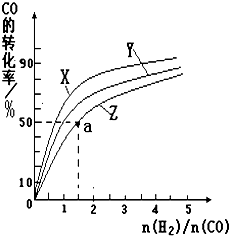
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度
(mol?L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
考点:转化率随温度、压强的变化曲线,用盖斯定律进行有关反应热的计算,化学平衡的计算
专题:
分析:①根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;
②ⅰ)合成甲醇的反应是放热反应,温度升高,转化率降低;
ⅱ)根据平衡常数表达式和一氧化碳的转化率求算;
③根据5min和10min时各物质浓度的变化来确定改变条件.
②ⅰ)合成甲醇的反应是放热反应,温度升高,转化率降低;
ⅱ)根据平衡常数表达式和一氧化碳的转化率求算;
③根据5min和10min时各物质浓度的变化来确定改变条件.
解答:
解:(1)根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ?mol-1,
②CO(g)+
O2(g)═CO2(g)△H2=-283kJ?mol-1,
③H2(g)+
O2(g)═H2O(g)△H3=-242kJ?mol-1 ,
根据盖斯定律:①-②-③×2得:
CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-651kJ?mol-1;
②ⅰ)根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案为:270℃;
ⅱ)该反应的平衡常数K=
,
a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol
剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
a点各组分的浓度是:c(CH3OH)=
=0.5mol/L,c(CO)=
=0.5mol/L,c(H2)=
=0.5mol/L,
带人表达式得:K=
=4L2?mol-2,
故答案为:4L2?mol-2.
③反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,
C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,
则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增加氢气的物质的量或增加氢气的浓度,
故答案为:增加氢气的物质的量或增加氢气的浓度.
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
根据盖斯定律:①-②-③×2得:
CH3OH(g)+
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
②ⅰ)根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案为:270℃;
ⅱ)该反应的平衡常数K=
| c(CH3OH) |
| c(CO)?c2(H2) |
a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol
剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
a点各组分的浓度是:c(CH3OH)=
| 1mol |
| 2L |
| 1mol |
| 2L |
| 1mol |
| 2L |
带人表达式得:K=
| 0.5mol/L |
| 0.5mol/L×(0.5mol/L)2 |
故答案为:4L2?mol-2.
③反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,
C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,
则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增加氢气的物质的量或增加氢气的浓度,
故答案为:增加氢气的物质的量或增加氢气的浓度.
点评:本题考查了化学平衡移动原理、盖斯定律等知识点,难点化学平衡移动的分析,要结合浓度该变量来确定改变条件,难度中等.

练习册系列答案
相关题目
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+
O2(g)═2CO2(g)+H2O(l);△H=-1300kJ?mol-1的说法中,正确的是( )
| 5 |
| 2 |
| A、10个电子转移时,该反应放出1300kJ的能量 |
| B、NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
下列对应反应的离子方程式书写正确的是( )
| A、过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 |
| B、NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH-═CO32-+H2O |
| C、稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═Fe2++I2 |
实验室盛装浓硫酸的试剂瓶上贴有的标识是( )
A、 |
B、 |
C、 |
D、 |
 硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+I2→S4O62-+2I-
硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+I2→S4O62-+2I-