题目内容
[I]有一包白色粉末状混合物,可能含有①KCl、②CaCO3、③KNO3、④Na2SO4、⑤MgCl2、⑥CuSO4中的某几种,现进行如下实验:
(1)将混合物加水溶解,得到无色透明溶液.
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,向另一份中加入NaOH溶液,也产生白色沉淀.
根据上述实验现象回答(填编号):
原混合物中,肯定没有 ,肯定有 ,不能确定是否含有 .
[II](1)质量分数为63%浓硝酸,其密度为1.385g/cm3,物质的量浓度为 .
(2)取1.43g Na2CO3?10H2O溶于水配成100mL溶液,Na+ 物质的量浓度为 ;取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)为 .
[III]标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,此混合气体中H2的质量为 ,CO体积为 .
(1)将混合物加水溶解,得到无色透明溶液.
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,向另一份中加入NaOH溶液,也产生白色沉淀.
根据上述实验现象回答(填编号):
原混合物中,肯定没有
[II](1)质量分数为63%浓硝酸,其密度为1.385g/cm3,物质的量浓度为
(2)取1.43g Na2CO3?10H2O溶于水配成100mL溶液,Na+ 物质的量浓度为
[III]标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,此混合气体中H2的质量为
考点:几组未知物的检验,物质的量的相关计算
专题:常规题型,物质检验鉴别题
分析:[Ⅰ]、(1)将混合物加水溶解,得到无色透明溶液,一定不含有:CaCO3、CuSO4;
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,一定含有Na2SO4,一定不含,向另一份中加入NaOH溶液,也产生白色沉淀,一定含MgCl2,其余的不能确定;
[II]、(1)根据c=
来计算;
(2)根据n=
求算出Na2CO3?10H2O的物质的量,从而求出Na+的物质的量,然后根据C=
;根据C浓V浓=C稀V稀来计算;
[III]、根据气体的体积和质量可列方程式计算相关物理量.
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,一定含有Na2SO4,一定不含,向另一份中加入NaOH溶液,也产生白色沉淀,一定含MgCl2,其余的不能确定;
[II]、(1)根据c=
| 1000ρw% |
| M |
(2)根据n=
| m |
| M |
| n |
| V |
[III]、根据气体的体积和质量可列方程式计算相关物理量.
解答:
解:[I]、(1)将混合物加水溶解,得到无色透明溶液,一定不含有:CaCO3、CuSO4;
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,一定含有Na2SO4,一定不含,向另一份中加入NaOH溶液,也产生白色沉淀,一定含MgCl2,其余的不能确定;即肯定没有②⑥,肯定有④⑤,不能确定是否含有①③,故答案为:②⑥;④⑤;①③;
[II]、(1)c=
=
=13.85 mol/L,故答案为:13.85 mol/L;
(2)根据n=
求的Na2CO3?10H2O的物质的量n=
=0.005mol,则n(Na+)=0.01mol,故Na+ 物质的量浓度为C=
=
=0.1mol/L;
设加入蒸馏水的体积为XL,根据C(Na+)=0.1mol/L可知C(Na2CO3)=0.05mol/L,根据C浓V浓=C稀V稀可知:0.05mol/L×0.02L=0.004mol/L×(0.02L+XL),解得:X=0.23L,即230mL,
故答案为:0.1mol/L;230mL;
[III]、n(H2)+n(CO)=
=0.4mol,
n(H2)×2g/mol+(0.4mol-n(H2))×28g/mol=6.0g,
n(H2)=0.2mol,
n(CO)=0.4mol-0.2mol=0.2mol,
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.2mol×28g/mol=5.6g,
V(CO)=V(H2)=0.2mol×22.4L/mol=4.48L,
故答案为:0.4 g;4.48 L.
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,加稀硝酸沉淀不溶解,一定含有Na2SO4,一定不含,向另一份中加入NaOH溶液,也产生白色沉淀,一定含MgCl2,其余的不能确定;即肯定没有②⑥,肯定有④⑤,不能确定是否含有①③,故答案为:②⑥;④⑤;①③;
[II]、(1)c=
| 1000ρw% |
| M |
| 1000×1.385g/cm3×63% |
| 63 |
(2)根据n=
| m |
| M |
| 1.43g |
| 286g/mol |
| n |
| V |
| 0.01mol |
| 0.1L |
设加入蒸馏水的体积为XL,根据C(Na+)=0.1mol/L可知C(Na2CO3)=0.05mol/L,根据C浓V浓=C稀V稀可知:0.05mol/L×0.02L=0.004mol/L×(0.02L+XL),解得:X=0.23L,即230mL,
故答案为:0.1mol/L;230mL;
[III]、n(H2)+n(CO)=
| 8.96L |
| 22.4L/mol |
n(H2)×2g/mol+(0.4mol-n(H2))×28g/mol=6.0g,
n(H2)=0.2mol,
n(CO)=0.4mol-0.2mol=0.2mol,
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.2mol×28g/mol=5.6g,
V(CO)=V(H2)=0.2mol×22.4L/mol=4.48L,
故答案为:0.4 g;4.48 L.
点评:本题考查了有关物质的鉴别、物质的量浓度的计算等知识,熟练掌握物质的性质以及公式的使用是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
区别溶液和胶体的最简单的方法是( )
| A、观察外观 | B、过滤 |
| C、静置后观察 | D、丁达尔效应 |
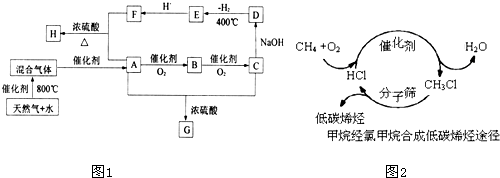

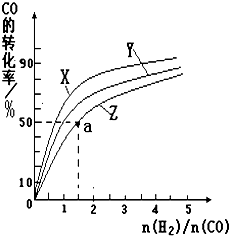 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为: