题目内容
4.归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后x形成溶液b,水的电离程度a>b.
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大.
④若将适量CO2 通入0.1mol•L-1 Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3ˉ)=0.1mol•L-1
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw( )
| A. | ①②④⑤ | B. | ②④⑤ | C. | ②⑤ | D. | ①③⑤ |
分析 ①可逆反应达到平衡时,平衡向着正向移动,则生成物的量一定增加;
②前者酸过量,过量的醋酸抑制了水的电离,后者恰好生成氯化钠,不影响水的电离;
③相铵根离子与银离子反应,导致氯化银的溶解平衡向着正向移动,而氯离子对氯化银的溶解平衡起到了抑制作用;
④任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{C(C{H}_{3}CO{O}^{-})}$,Kw=c(H+).c(OH-).
解答 解:①可逆反应达到平衡时,改变条件后平衡向着正向移动,生成物的物质的量增大,在生成物的产量一定增加,故①正确;
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,由于醋酸为弱酸,则混合液中醋酸过量,过量的醋酸抑制了水的电离;等浓度的盐酸与NaOH溶液等体积混合后x形成溶液b,b为NaCl溶液,钠离子和硫离子不影响水的电离,所以水的电离程度a<b,故②错误;
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,由于铵根离子与银离子反应促进了溶解平衡向着氯化银溶解的方向移动,而氯离子抑制了氯化银的溶解,所以氯化银的溶解度前者较大,故③正确;
④溶液呈中性,则c(H+)=c(OH-),根据溶液中的电荷守恒得:2c(CO32-)+c(HCO3ˉ)=c(Na+)=0.2mol•L-1,故④错误;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{C(C{H}_{3}CO{O}^{-})}$,Kw=c(H+)•c(OH-),所以满足:Ka•Kh=Kw,故⑤正确;
故选D.
点评 本题考查较综合,涉及化学平衡、弱电解质的电离、盐类水解、难溶物溶解平衡等知识点,为高频考点,题目难度中等,明确电解质电离特点、难溶物溶解平衡影响因素等知识点是解本题关键,难点是⑤,注意掌握电离平衡常数、水的离子积及水解平衡常数之间关系.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案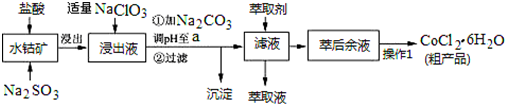
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..
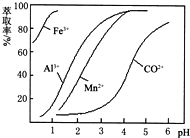
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
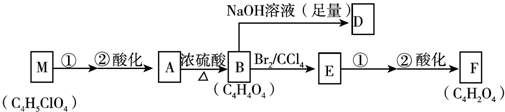
 +(2n-1)H2O.
+(2n-1)H2O. .
.
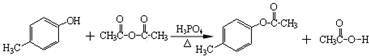 .
.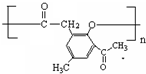 .
.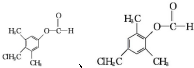 .
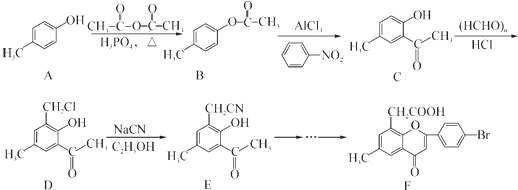
.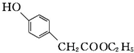 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: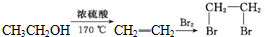
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3. .
.