题目内容
铁矿石的主要成分为铁的氧化物,是工业炼铁的主要原料之一,有研究性学习小组对某铁矿石中铁和氧的含量进行探究.(设铁矿石杂质不含铁元素和氧元素,且杂质不与H2SO4反应).
实验一:铁矿石中含铁量的测定
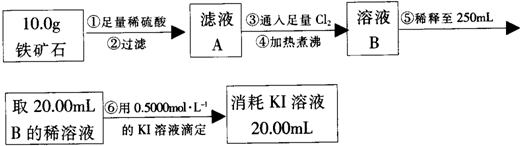
(1)滤液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: .
a.氯水 b.NaOH溶液 c.KSCN溶液 d.酸性KMnO4溶液
(2)步骤④中煮沸的目的是 .
(3)步骤⑤中用到的玻璃仪器除了玻璃棒、胶头滴管,还有 .
(4)下列有关步骤⑥的操作中说法不正确的是 .
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
e.滴定过程中,眼睛注视滴定管中液面变化
(5)铁矿石中铁的质量分数为 .
实验二:铁矿石中含氧量的测定

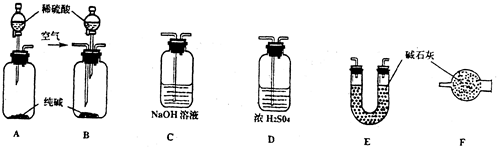
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(6)装置C的作用为 .
(7)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为 .
实验一:铁矿石中含铁量的测定

(1)滤液A中铁元素可能的存在形式
a.氯水 b.NaOH溶液 c.KSCN溶液 d.酸性KMnO4溶液
(2)步骤④中煮沸的目的是
(3)步骤⑤中用到的玻璃仪器除了玻璃棒、胶头滴管,还有
(4)下列有关步骤⑥的操作中说法不正确的是
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
e.滴定过程中,眼睛注视滴定管中液面变化
(5)铁矿石中铁的质量分数为
实验二:铁矿石中含氧量的测定

a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(6)装置C的作用为
(7)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:实验一:铁矿石和稀硫酸反应生成硫酸盐和水,然后过滤得到滤液A,向滤液中通入足量Cl2,Cl2具有强氧化性,能将Fe 2+氧化为Fe 3+,然后煮沸得到溶液B,将溶液B稀释,向溶液B中加入KI溶液,Fe 3+和碘离子发生氧化还原反应生成Fe 2+和I2,先根据碘离子和铁离子关系式计算铁离子的物质的量,根据铁原子守恒计算其质量分数;
实验二:在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果;测得反应后装置B增重1.35g,B增重的质量为水的质量,
水中O元素质量=1.35g×
×100%=1.2g,由此计算氧元素质量分数.
实验二:在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果;测得反应后装置B增重1.35g,B增重的质量为水的质量,
水中O元素质量=1.35g×
| 16 |
| 18 |
解答:
解:实验一:铁矿石和稀硫酸反应生成硫酸盐和水,然后过滤得到滤液A,向滤液中通入足量Cl2,Cl2具有强氧化性,能将Fe 2+氧化为Fe 3+,然后煮沸得到溶液B,将溶液B稀释,向溶液B中加入KI溶液,Fe 3+和碘离子发生氧化还原反应生成Fe 2+和I2;
(1)稀硫酸具有弱氧化性,不能将+2价铁氧化为+3价,所以滤液A中铁元素可能的存在形式Fe 2+、Fe 3+;Fe 2+具有还原性能被强氧化剂氧化、Fe 3+用KSCN溶液检验,向滤液A中加入KSCN溶液检验是否含有铁离子,如果溶液不变红色,说明不含铁离子,然后向溶液中加入氯水,如果此时溶液变红色,说明溶液中含有亚铁离子,故选ac;
故答案为:Fe 2+、Fe 3+;ac;
(2)升高温度抑制氯气溶解,所以步骤④中煮沸的目的是除去过量的氯气,防止对实验造成干扰,故答案为:除去过量氯气;
(3)步骤⑤中用到的玻璃仪器除了玻璃棒、胶头滴管,还有250mL容量瓶、烧杯,故答案为:250mL容量瓶、烧杯;
(4)a.滴定管用蒸馏水洗涤后必须用待装液润洗,故a正确;
b.锥形瓶不需要用待测液润洗,故b正确;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
d.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,故d正确;
e.滴定过程中,眼睛注视锥形瓶内溶液颜色变化,故e错误;
故选ce;
(5)碘离子和铁离子反应方程式为2 Fe3++2 I-=I2+2Fe2+,根据碘离子和铁离子的关系式得n( Fe3+)=n( I-)=0.5000mol/L×0.020L=0.01mol,250mLB溶液中n( Fe3+)=0.01mol×12.5=0.125mol,
m(Fe)=0.125mol×56g/mol=7.0g,铁矿石中铁的质量分数为
×100%=70%,
故答案为:70%;
实验二:(6)在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(7)测得反应后装置B增重1.35g,B增重的质量为水的质量,水中O元素质量=1.35g×
×100%=1.2g,铁矿石中氧元素质量分数=
×100%=24%,
故答案为:24%.
(1)稀硫酸具有弱氧化性,不能将+2价铁氧化为+3价,所以滤液A中铁元素可能的存在形式Fe 2+、Fe 3+;Fe 2+具有还原性能被强氧化剂氧化、Fe 3+用KSCN溶液检验,向滤液A中加入KSCN溶液检验是否含有铁离子,如果溶液不变红色,说明不含铁离子,然后向溶液中加入氯水,如果此时溶液变红色,说明溶液中含有亚铁离子,故选ac;
故答案为:Fe 2+、Fe 3+;ac;
(2)升高温度抑制氯气溶解,所以步骤④中煮沸的目的是除去过量的氯气,防止对实验造成干扰,故答案为:除去过量氯气;
(3)步骤⑤中用到的玻璃仪器除了玻璃棒、胶头滴管,还有250mL容量瓶、烧杯,故答案为:250mL容量瓶、烧杯;
(4)a.滴定管用蒸馏水洗涤后必须用待装液润洗,故a正确;
b.锥形瓶不需要用待测液润洗,故b正确;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
d.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,故d正确;
e.滴定过程中,眼睛注视锥形瓶内溶液颜色变化,故e错误;
故选ce;
(5)碘离子和铁离子反应方程式为2 Fe3++2 I-=I2+2Fe2+,根据碘离子和铁离子的关系式得n( Fe3+)=n( I-)=0.5000mol/L×0.020L=0.01mol,250mLB溶液中n( Fe3+)=0.01mol×12.5=0.125mol,
m(Fe)=0.125mol×56g/mol=7.0g,铁矿石中铁的质量分数为
| 7.0g |
| 10.0g |
故答案为:70%;
实验二:(6)在加热条件下,氢气和铁矿石发生氧化还原反应生成Fe和水,碱石灰吸收生成的水蒸气,C中碱石灰吸收空气中水蒸气、二氧化碳,防止干扰测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(7)测得反应后装置B增重1.35g,B增重的质量为水的质量,水中O元素质量=1.35g×
| 16 |
| 18 |
| 1.2g |
| 5.0g |
故答案为:24%.
点评:本题考查物质含量的测定,侧重考查分析、实验、计算能力,明确实验原理是解本题关键,知道流程图中发生的反应,注意容量瓶要注明规格,知道实验二中C装置的作用,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关反应热的叙述正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为-241.8kJ/mol |
| B、由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
| C、X(g)+Y(g)?Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 |
| D、已知C(s)+O2(g)=CO2(g)△H1,C(s)+1/2O2(g)=CO(g)△H2,则△H1<△H2 |
下列气体属于温室效应气体的是( )
| A、CO2 |
| B、N2O |
| C、CH4 |
| D、N2 |

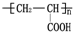 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是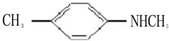 、
、