题目内容
下列电子排布图能表示氮原子的最低能量状态的是( )
A、 |
B、 |
C、 |
D、 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则,氮原子能量最低是: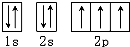 .
.
 .
.解答:
解:由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,氮原子能量最低排布是: ,
,
故选C.
 ,
,故选C.
点评:本题考查核外电子排布规律,难度不大,注意核外电子排布规律的理解与灵活运用.

练习册系列答案
相关题目
对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、钠元素化合价降低 |
| C、Cl2既做氧化剂又做还原剂 |
| D、氧化剂得电子数与还原剂失电子数之比为5:1 |
下列气态氢化物中,最不稳定的是( )
| A、HI | B、HBr |
| C、HCl | D、HF |
下列有关反应热的叙述正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为-241.8kJ/mol |
| B、由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
| C、X(g)+Y(g)?Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 |
| D、已知C(s)+O2(g)=CO2(g)△H1,C(s)+1/2O2(g)=CO(g)△H2,则△H1<△H2 |
下列说法中,正确的是( )
| A、CO2的摩尔质量为44g |
| B、标准状况下,1molCO2所占的体积约是22.4L |
| C、1molN2的质量是14g |
| D、将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
设NA为阿伏加德罗常数,则下列说法正确的是( )
| A、1molNa2O2含有阴阳离子总数为4NA |
| B、0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA |
| C、常温常压,22.4L CO2中含有CO2分子NA个 |
| D、18 g水中含有的电子数为10NA |
下列离子方程式中,属于水解反应的是( )
| A、CH3COOH+H2O?CH3COO-+H3O+ |
| B、SO2+H2O?HSO3-+H+ |
| C、H2O+H2O?H3O++OH- |
| D、NH4++H2O?NH3.H2O+H+ |