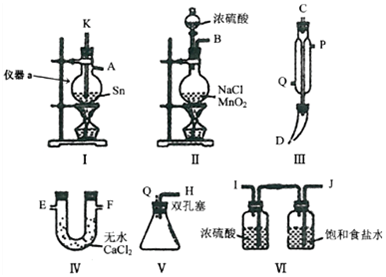
题目内容
17.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
分析 A.电解饱和食盐水时,阳极上氯离子失电子生成氯气;
B.氢氧燃料电池中氢气在负极失电子;
C.粗铜精炼时,与电源正极相连的是阳极,所以是粗铜;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应.
解答 解:A.用惰性电极电解饱和食盐水,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,故A正确;
B.酸性氢氧燃料电池中,负极上燃料失电子生成氢离子,负极反应式为H2-2e-=2H+,故B错误;
C.粗铜精炼时,与电源正极相连的是阳极,所以是粗铜,而不是纯铜,故C错误;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故D错误;
故选A.
点评 本题考查电极反应式的书写,明确各个电极上发生的反应是解本题关键,书写电极反应式要结合电解质溶液酸碱性,也是学习难点,题目难度不大.

练习册系列答案
相关题目
7.下列有关原理叙述正确的是( )
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
8.下列各组中的离子,因发生氧化还原反应而不能大量共存同一溶液中的是( )
| A. | Fe2+、SO42-、Fe3+、Cl- | B. | S2-、Cu2+、Na+、Cl- | ||
| C. | H+、SO42-、Cu2+、OH- | D. | Fe2+、H+、Mg2+、NO3- |
5.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 17g NH3所含的电子数是17NA | |
| B. | 32 g O3中含有氧原子的个数为2NA | |
| C. | 5.6gFe与足量盐酸完全反应,Fe失去的电子数为0.3NA | |
| D. | 标准状况下,11.2 LH2O中含有O-H键的数目为NA |
6.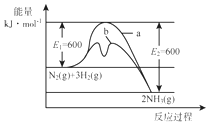 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
(4)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液可构成新型燃料电池,同时达到固氮作用.该电池的正极反应式为N2+6e-+8H+=2NH4+.
 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
7.下列说法正确的是( )
| A. | 石油的分馏和煤的液化都是发生了物理变化 | |
| B. | 乙烯和乙炔都能与溴水发生加成反应且生成的产物相同 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色 |