题目内容
11.天然存在的金属钫(Fr)极微量.它的21个已知同位素都有放射性.它是碱金属元素中最重的元素.根据它在周期表中的位置预言其性质,其中正确的是( )| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是弱碱 | D. | 其单质的熔点比金属钠的熔点高 |
分析 Fr属于碱金属元素,位于第七周期,根据同主族元素性质的相似性和递变性解答该题.
解答 解:A.同主族元素从上到下原子半径逐渐增大,同周期从左到右原子半径逐渐减小,则则Fr在周期表中具有最大的原子半径,故A正确;
B.在碱金属元素中只有Li生成Li2O,其它元素对应的单质能生成氧化物、过氧化物、超氧化物等,故B错误;
C.Fr在碱金属中元素的金属性最强,对应的氧化物的水化物的碱性极强,故C错误;
D.碱金属元素从上到下单质的熔点逐渐降低,故Fr单质的熔点比金属钠的熔点低,故D错误;
故选:A.
点评 本题考查了钫的性质,明确同主族元素性质递变规律是解题关键,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
17.表示0.1mol/LNaHCO3溶液中有关微粒浓度的关系式中正确的是( )
| A. | c (Na+)>c (HCO3-)>c (CO32-)>c(H+)>c(OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | c (Na+)=c (HCO3-) | |
| D. | c (Na+)+c(H+)=c (HCO3-)+2c (CO32-)+c(OH-)+c(H2CO3) |
15.下列叙述不正确的是( )
| A. | 苯中的少量苯酚可先加适量的溴水,再过滤而除去 | |
| B. | 将苯酚晶体放人少量水中,加热时全部溶解,冷却后形成乳浊液 | |
| C. | 苯酚的酸性很弱,不能使酸碱指示剂变色 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
6.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
3.A元素最高正价和负价绝对值之差为6,B元素次外层有8个电子,BA2在水溶液中能电离出相同电子层结构的离子,则BA2是( )
| A. | CaCl2 | B. | CaF2 | C. | NO2 | D. | CO2 |
20.某烃的结构简示为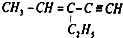 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
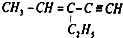 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 3,3,6 | B. | 2,3,5 | C. | 2,5,4 | D. | 4,6,4 |
1.氢气在氧气中燃烧时产生淡蓝色火焰.在反应中,破坏1mol氢气中的化学键消耗能量为Q1KJ,破坏1mol氧气中的化学键消耗能量为Q2KJ,形成1molO-H化学键释放的能量为Q3KJ.下列说法正确的是( )
| A. | 2Q1+Q2>4Q3 | |
| B. | Q1+Q2<Q3 | |
| C. | 1mol氧气和2mol氢气的总能量高于1mol水的总能量 | |
| D. | 1mol氧气和2mol氢气的总能量低于1mol水的总能量 |
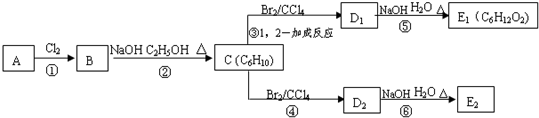
 .
.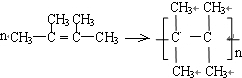 .
.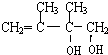 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
. ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.