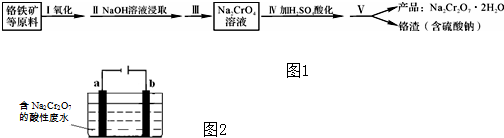
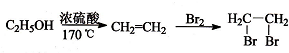题目内容
16.(1)写出下列具有10个电子的粒子的化学式:原子的原子结构示意图 ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大.已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8.
①写出Y元素的名称碳.
②写出W元素在周期表中的位置第三周期第ⅦA族.
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式Na2O+2HNO3═2NaNO3+H2O.
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:NaOH,H2CO3,HNO3,HClO4.
分析 (1)具有10个电子的原子为Ne;由2个原子组成的分子为HF;由2个原子组成的阴离子是OH-;
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
解答 解:(1)具有10个电子的原子为Ne,原子结构示意图为 ;由2个原子组成的分子为HF;由2个原子组成的阴离子是OH-,
;由2个原子组成的分子为HF;由2个原子组成的阴离子是OH-,
故答案为: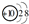 ;HF;OH-;
;HF;OH-;
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
①Y元素的名称为碳,故答案为:碳;
②W为Cl元素,在周期表中的位置:第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
③X的最高价氧化物为Na2O,Z的最高价氧化物对应水化物为HNO3,二者反应的化学方程式:Na2O+2HNO3═2NaNO3+H2O,
故答案为:Na2O+2HNO3═2NaNO3+H2O;
④金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为:NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
点评 本题考查结构性质位置关系应用,正确推断元素的种类为解答该题的关键,有利于基础知识的巩固.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 未加盐酸时,c (Na+)+c(OH-)=c(NH3•H2O) | |
| B. | 加入10mL盐酸时,c(NH4+)+c(H+)=c(OH-) | |
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c (Na+) | |
| D. | 加入20mL盐酸时,c(Cl-)=c(NH4+)+c (Na+) |
| A. | $\frac{a-3}{12}$mol | B. | $\frac{a-27}{12}$mol | C. | $\frac{a-81}{18}$mol | D. | $\frac{a-9}{18}$mol |
| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是弱碱 | D. | 其单质的熔点比金属钠的熔点高 |
| A. | Mg的金属性比Al强 | B. | H-的离子半径大于Li+ | ||
| C. | HCl的热稳定性比HF强 | D. | HClO4的酸性比H3PO4强 |
 .请回答下列问题:
.请回答下列问题: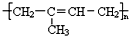 .
.
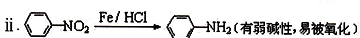
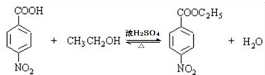 .
.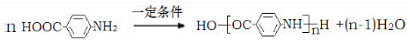
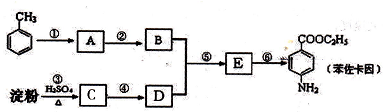
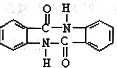 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图: