题目内容
按要求填空:
(1)除去NaHCO3溶液中的少量Na2CO3,方法是: ;离子方程式为: .
(2)呼吸面具中所用的药品是 ;反应的化学方程式为: .
(3)由铝盐制取氢氧化铝,所用的试剂为: ;离子方程式为: .
(4)白色的Fe(OH)2在空气中发生的颜色变化为 .
(5)写出硅酸钠溶液在空气中变质的化学方程式: .
(6)写出用熟石灰吸收氯气制漂白粉的化学方程式: .
(7)将CaMg3Si4O12改写为氧化物的形式: .
(1)除去NaHCO3溶液中的少量Na2CO3,方法是:
(2)呼吸面具中所用的药品是
(3)由铝盐制取氢氧化铝,所用的试剂为:
(4)白色的Fe(OH)2在空气中发生的颜色变化为
(5)写出硅酸钠溶液在空气中变质的化学方程式:
(6)写出用熟石灰吸收氯气制漂白粉的化学方程式:
(7)将CaMg3Si4O12改写为氧化物的形式:
考点:常见金属元素的单质及其化合物的综合应用,氯、溴、碘及其化合物的综合应用,硅酸的性质及制法
专题:卤族元素,碳族元素,几种重要的金属及其化合物
分析:(1)碳酸钠在溶液中和二氧化碳反应生成碳酸氢钠;
(2)呼吸面具中的供氧剂是过氧化钠和呼出的二氧化碳反应生成氧气;
(3)氢氧化铝不溶于弱酸弱碱,利用铝盐和一水合氨反应生成氢氧化铝沉淀;
(4)氢氧化亚铁具有还原性在空气中被氧气为灰绿色最后变化为红褐色氢氧化铁;
(5)碳酸酸性大于硅酸,硅酸钠溶液吸收空气中的二氧化碳生成硅酸沉淀;
(6)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(7)依据元素化合价和原子守恒书写氧化物形式;
(2)呼吸面具中的供氧剂是过氧化钠和呼出的二氧化碳反应生成氧气;
(3)氢氧化铝不溶于弱酸弱碱,利用铝盐和一水合氨反应生成氢氧化铝沉淀;
(4)氢氧化亚铁具有还原性在空气中被氧气为灰绿色最后变化为红褐色氢氧化铁;
(5)碳酸酸性大于硅酸,硅酸钠溶液吸收空气中的二氧化碳生成硅酸沉淀;
(6)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(7)依据元素化合价和原子守恒书写氧化物形式;
解答:
解:(1)除去NaHCO3溶液中的少量Na2CO3,向溶液中通入过量的二氧化碳气体反应生成碳酸氢钠,反应的离子方程式为:CO2+CO32-+H2O=2HCO3-;
故答案为:通入过量的CO2;CO2+CO32-+H2O=2HCO3-;
(2)呼吸面具中的供氧剂是过氧化钠和呼出的二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2↑;
故答案为:过氧化钠;2Na2O2+2CO2=2Na2CO3+O2↑;
(3)利用铝盐和一水合氨反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:氨水和可溶性铝盐(或氨水和硫酸铝或氯化铝);Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)氢氧化亚铁具有还原性在空气中被氧气为灰绿色最后变化为红褐色氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:白色迅速变为灰绿色最终变为红褐色;
(5)碳酸酸性大于硅酸,硅酸钠溶液吸收空气中的二氧化碳生成硅酸沉淀,反应的化学方程式为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
故答案为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(6)氯气和石灰乳反应生成氯化钙、次氯酸钙和水反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(7)依据元素化合价和原子守恒书写氧化物形式,CaMg3Si4O12改写为氧化物的形式为:CaO?3MgO?4SiO2;
故答案为:CaO?3MgO?4SiO2;
故答案为:通入过量的CO2;CO2+CO32-+H2O=2HCO3-;
(2)呼吸面具中的供氧剂是过氧化钠和呼出的二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2↑;
故答案为:过氧化钠;2Na2O2+2CO2=2Na2CO3+O2↑;
(3)利用铝盐和一水合氨反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:氨水和可溶性铝盐(或氨水和硫酸铝或氯化铝);Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)氢氧化亚铁具有还原性在空气中被氧气为灰绿色最后变化为红褐色氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:白色迅速变为灰绿色最终变为红褐色;
(5)碳酸酸性大于硅酸,硅酸钠溶液吸收空气中的二氧化碳生成硅酸沉淀,反应的化学方程式为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
故答案为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(6)氯气和石灰乳反应生成氯化钙、次氯酸钙和水反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(7)依据元素化合价和原子守恒书写氧化物形式,CaMg3Si4O12改写为氧化物的形式为:CaO?3MgO?4SiO2;
故答案为:CaO?3MgO?4SiO2;
点评:本题考查了物质性质的分析,化学方程式、离子方程式书写方法,混合物除杂,掌握基础是关键,注意知识的熟练运用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
欲将蛋白质从水中析出而又不改变它的性质,应加入( )?
| A、甲醛溶液 |
| B、饱和Na2SO4溶液 |
| C、饱和(NH4)2SO4溶液 |
| D、醋酸铅溶液 |
取金属Na、Mg、Al各0.1mol,分别投入均盛有100mL 0.5mol/L盐酸的烧杯中,充分反应后放出H2的体积( )
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
下列对各种平衡体系的叙述中,不正确的是( )
| A、一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、某温度下,容积一定的密闭容器中进行可逆反应,X(g)+Y(g)?2Z(g)+W(s)△H>0平衡后,升高温度,c(Z)增大 |
| C、常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动 |
| D、在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |


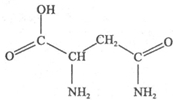 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.