题目内容
 一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:
一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
A.v(NO2)=4v(O2) B.容器内压强保持不变
C.v逆(N2O5)=2v正(O2) D.容器内密度保持不变
(2)反应达到平衡后,NO2的转化率为
(3)图中能表示N2O5的浓度变化的曲线是
(4)能使该反应的反应速率增大,且平衡向正应方向移动的是
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据化学反应处于平衡状态时,各组成成份不变,正逆反应速率相等及有关物理量的变化特征可以判断;
(2)根据转化率=
可以计算,加入氮气后反应中的有关物质的浓度没有变化,据此判断转化率的变化;
(3)根据反应物浓度减小,生成物尝试增加,反应中各物质的变化量之比等于计量数之比,可以判断;
(4)根据影响化学反应速率和化学平衡移动的外界因素可以判断.
(2)根据转化率=
| 已转化了的物质的量 |
| 起始的物质的量 |
(3)根据反应物浓度减小,生成物尝试增加,反应中各物质的变化量之比等于计量数之比,可以判断;
(4)根据影响化学反应速率和化学平衡移动的外界因素可以判断.
解答:
解:(1)根据化学反应处于平衡状态时,各组成成份不变,正逆反应速率相等及有关物理量的变化特征可知,
A.v(NO2)=4v(O2),但未指明是正反应还是逆反应速率,故A错误;
B.由于该反应是前后气体计量数改变的反应,所以容器内压强保持不变时,则说明反应已经处于平衡状态,故B正确;
C.v逆(N2O5)=2v正(O2),则说明正逆反应速率相等,故C正确;
D.由于反应在恒容条件下进行,反应前后气体质量守恒,所以反应过程中密度始终不变,所以容器内密度保持不变无法判断反应是否处于平衡,故D错误;
故选BC.
(2)由表可知,参加反应的NO2的物质的量为20mol-10.08mol=9.92mol,根据转化率=
可知,NO2的转化率为
×100%=49.6%,加入氮气后反应中的有关物质的浓度没有变化,所以NO2的转化率的没有变化,故答案为:49.6%;不变;
(3)根据反应物浓度减小,生成物尝试增加,反应中各物质的变化量之比等于计量数之比,根据方程式可知,氧气是二氧化氮的反应速率的四分之一,五氧化二氮是二氧化氮的二分之一,结合图可知c为五氧化二氮的变化曲线,a为二氧化氮的变化曲线,v(NO2)=
=6.04×10-3mol/(L?s),v(O2)=
v(NO2)=1.51×10-3mol/(L?s),故答案为:c;1.51×10-3mol/(L?s);
(4)A.及时分离出NO2气体,降低了生成物浓度,平衡逆向移动,浓度下降,反应速率下降,故A错误;
B.由于该反应是放热反应,适当升高温度,反应速率增大,平衡逆向移动,故B错误;
C.增大O2的浓度,增大反应物浓度平衡正向移动,反应速率增大,故C正确;
D.选择高效催化剂,平衡不移动,反应速率变大,故D错误;
故选C.
A.v(NO2)=4v(O2),但未指明是正反应还是逆反应速率,故A错误;
B.由于该反应是前后气体计量数改变的反应,所以容器内压强保持不变时,则说明反应已经处于平衡状态,故B正确;
C.v逆(N2O5)=2v正(O2),则说明正逆反应速率相等,故C正确;
D.由于反应在恒容条件下进行,反应前后气体质量守恒,所以反应过程中密度始终不变,所以容器内密度保持不变无法判断反应是否处于平衡,故D错误;
故选BC.
(2)由表可知,参加反应的NO2的物质的量为20mol-10.08mol=9.92mol,根据转化率=
| 已转化了的物质的量 |
| 起始的物质的量 |
| 9.92mol |
| 20mol |
(3)根据反应物浓度减小,生成物尝试增加,反应中各物质的变化量之比等于计量数之比,根据方程式可知,氧气是二氧化氮的反应速率的四分之一,五氧化二氮是二氧化氮的二分之一,结合图可知c为五氧化二氮的变化曲线,a为二氧化氮的变化曲线,v(NO2)=
| ||
| 500s |
| 1 |
| 4 |
(4)A.及时分离出NO2气体,降低了生成物浓度,平衡逆向移动,浓度下降,反应速率下降,故A错误;
B.由于该反应是放热反应,适当升高温度,反应速率增大,平衡逆向移动,故B错误;
C.增大O2的浓度,增大反应物浓度平衡正向移动,反应速率增大,故C正确;
D.选择高效催化剂,平衡不移动,反应速率变大,故D错误;
故选C.
点评:本题考查了热化学方程式、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,难度中等,注意做题方法、判断规律的积累.

练习册系列答案
相关题目
 如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是
如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是( )
| A、试纸A端发生还原反应 |
| B、Ag+从银电极移向石墨,K+移向A端 |
| C、试纸B端出现棕色 |
| D、石墨上电极反应式:I2+2e-=2I- |
一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示的该反应的平均反应速率υ(H2)是( )
| A、0.1mol/(L?min) |
| B、0.2mol/(L?min) |
| C、0.3mol/(L?min) |
| D、0.6mol/(L?min) |
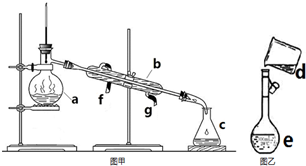 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.