题目内容
 如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是
如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是( )
| A、试纸A端发生还原反应 |
| B、Ag+从银电极移向石墨,K+移向A端 |
| C、试纸B端出现棕色 |
| D、石墨上电极反应式:I2+2e-=2I- |
考点:化学电源新型电池
专题:电化学专题
分析:Ag和I2作用形成原电池,生成物为RbAg4I5,可知在反应中Ag被氧化,为电池的负极反应,I2被还原,为原电池的正极反应,原电池工作时,阳离子向正极移动,阴离子向负极移动;
A与正极相连为阳极,B与负极相连为阴极,根据阴阳两极上的反应分析.
A与正极相连为阳极,B与负极相连为阴极,根据阴阳两极上的反应分析.
解答:
解:Ag和I2作用形成原电池,生成物为RbAg4I5,可知在反应中Ag被氧化,为电池的负极反应,I2被还原,为原电池的正极反应,原电池工作时,阳离子向正极移动,阴离子向负极移动;A与正极相连为阳极,B与负极相连为阴极,
A、试纸A端为阳极,为碘离子失电子发生氧化反应,故A错误;
B、原电池中阳离子向正极移动,即Ag+从银电极移向石墨,电解池中K+移向阴极移动即向B端移动,故B错误;
C、试纸A端为阳极,为碘离子失电子发生氧化反应生成单质碘,所以试纸A端出现棕色,故C错误;
D、石墨电极为正极,正极上I2得电子生成碘离子,其电极反应式:I2+2e-=2I-,故D正确;
故选D.
A、试纸A端为阳极,为碘离子失电子发生氧化反应,故A错误;
B、原电池中阳离子向正极移动,即Ag+从银电极移向石墨,电解池中K+移向阴极移动即向B端移动,故B错误;
C、试纸A端为阳极,为碘离子失电子发生氧化反应生成单质碘,所以试纸A端出现棕色,故C错误;
D、石墨电极为正极,正极上I2得电子生成碘离子,其电极反应式:I2+2e-=2I-,故D正确;
故选D.
点评:本题考查原电池原理和电解池原理的应用,题目难度不大,注意根据生成物判断原电池的正负极,为解答该题的关键,注意原电池的正负极的判断,把握电极反应式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列电离方程式正确的是( )
A、Al2(SO4)3=Al3++S
| ||
B、H2SO2═2H++S
| ||
| C、Ba(OH)2=Ba2++(OH-)2 | ||
D、KOH=K++
|
在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式…主要污染物排放得到有效控制.”下列做法符合该指导思想的是( )
| A、大量使用合成洗涤剂洗涤衣物 |
| B、大量使用尿素替代碳酸氢铵以提高农作物产量 |
| C、大量使用一次性竹、木筷子以推动林业发展 |
| D、大量利用垃圾生产燃料、肥料“变废为宝” |
金属碘化物跟单质I2化合可生成多碘化物,如:KI+I2?KI3,叙述不正确的是( )
| A、在KI溶液中I2的溶解度增大是由于生成I3-离子 |
| B、I3-在溶液中存在下列平衡:I3-?I2+I- |
| C、KI3溶液遇淀粉溶液不呈蓝色 |
| D、将Cl2通入KI3溶液中,I3-浓度减小 |
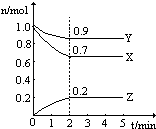 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白: 一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:
一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表: (1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:
(1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据: