题目内容
(1)肼(N2H4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是: .
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,肼-空气燃料电池放电时:负极的电极反应式是: .
(3)使用肼-空气燃料电池作为电源,以铜片作阳极电解CuSO4溶液,电极质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%).
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,肼-空气燃料电池放电时:负极的电极反应式是:
(3)使用肼-空气燃料电池作为电源,以铜片作阳极电解CuSO4溶液,电极质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气
考点:化学电源新型电池,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)根据转移电子相等计算需要空气的体积.
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)根据转移电子相等计算需要空气的体积.
解答:
解:(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;
(3)若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
=112L,
故答案为:112.
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;
(3)若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
| 128g |
| 64g/mol |
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
| ||
| 20% |
故答案为:112.
点评:本题考查了盖斯定律、原电池和电解池原理,明确原电池和电解池中放电顺序及串联电路中转移电子数相等即可解答,难度中等.

练习册系列答案
相关题目
在能使紫色石蕊试剂变红的溶液中,下列各离子组能大量共存于该溶液的是( )
| A、K+ SO42-,ClO- |
| B、K+.NH4+,Cl- |
| C、Na+,K+,CO32- |
| D、Na+,Fe3+,I- |
在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式…主要污染物排放得到有效控制.”下列做法符合该指导思想的是( )
| A、大量使用合成洗涤剂洗涤衣物 |
| B、大量使用尿素替代碳酸氢铵以提高农作物产量 |
| C、大量使用一次性竹、木筷子以推动林业发展 |
| D、大量利用垃圾生产燃料、肥料“变废为宝” |
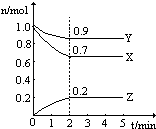 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白: 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质. (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式 一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:
一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表: