题目内容
11. 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值偏小(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小(填“偏大”、“偏小”或“无影响”,下同);用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和反应热的数值会偏小.
分析 (1)图中缺少搅拌仪器,使酸碱迅速混合;
(2)如不盖硬纸板,热量散失,不能准确测定最高温度;
(3)一水合氨电离吸热,用50mL 0.50mol/L NaOH溶液进行上述实验,不能保证HCl完全反应.
解答 解:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)如不盖硬纸板,热量散失,不能准确测定最高温度,则求得的中和反应热数值偏小,故答案为:偏小;
(3)一水合氨电离吸热,则用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小;用50mL 0.50mol/L NaOH溶液进行上述实验,用50mL 0.50mol/L NaOH溶液进行上述实验,不能保证HCl完全反应,测得的中和反应热的数值会偏小,
故答案为:偏小;偏小.
点评 本题考查中和热的测定,为高频考点,把握测定原理、实验装置、实验技能为解答的关键,侧重分析与实验能力的考查,注意电离吸热及保证HCl完全反应,题目难度不大.

练习册系列答案
相关题目
19.(1)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂,实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:
①实验步骤b明显不合理,理由是应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在.
②实验步骤d中用少量冰水洗涤晶体,其目的是洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
请根据表中数据作出硫酸亚铁的溶解度曲线.
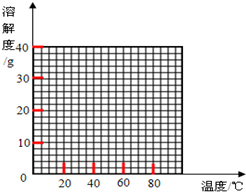
(3)若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃.
(4)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
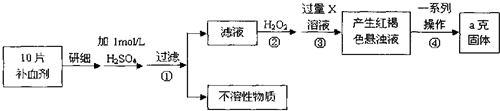
请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:氯水(或双氧水、稀硝酸);溶液由浅绿色变为血红色.
②步骤④中一系列处理的操作步骤:过滤、灼烧、称量.
③若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:
①实验步骤b明显不合理,理由是应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在.
②实验步骤d中用少量冰水洗涤晶体,其目的是洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||

(3)若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃.
(4)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:氯水(或双氧水、稀硝酸);溶液由浅绿色变为血红色.
②步骤④中一系列处理的操作步骤:过滤、灼烧、称量.
③若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
6.对于反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)的平衡常数K1,下列表述一定正确的是( )
| A. | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B. | 增大c(H2O)或减小c(H2),会使平衡常数K1减小 | |
| C. | 改变反应的温度,平衡常数K1不一定变化 | |
| D. | Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数为K2,K1×K2=1 |
16.下列判断正确的是( )
| A. | 同温、同压下,相同体积的氮气和氦气所含的原子数相等 | |
| B. | 标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA | |
| C. | 1 mol氯气和足量NaOH溶液反应转移的电子数为2NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
1.将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素肯定不是( )
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
 N和Si是合成新型非金属材料的两种重要元素.请回答:
N和Si是合成新型非金属材料的两种重要元素.请回答: ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
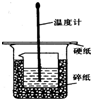 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: