题目内容
9. 如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )
如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )| A. | 2:2:4:1 | B. | 1:1:2:1 | C. | 2:1:l:1 | D. | 2:2:2:1 |
分析 根据电解方程式:E池中,阳极电极反应式为:2Cl--2e-=Cl2↑,阴极电极反应式为:Cu2++2e-=Cu;F池中,阳极发生4OH--4e-=2H2O+O2↑,阴极Ag++e-=Ag,据电子守恒分析.
解答 解:根据电解方程式:E池中,阳极电极反应式为:2Cl--2e-=Cl2↑,阴极电极反应式为:Cu2++2e-=Cu;F池中,阳极发生4OH--4e-=2H2O+O2↑,阴极Ag++e-=Ag,据电子守恒,假设转移4mol电子,E池中阳极b生成2mol氯气,阴极a生成2molCu,F池中阳极d生成1mol氧气,阴极c生成4molAg,所以a、b、c、d四个电极上所析出的物质的物质的量之比是2:2:4:1,故选A.
点评 本题考查学生电解池的工作原理以及电池反应的应用和计算,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.(1)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂,实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:
①实验步骤b明显不合理,理由是应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在.
②实验步骤d中用少量冰水洗涤晶体,其目的是洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
请根据表中数据作出硫酸亚铁的溶解度曲线.
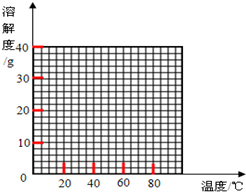
(3)若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃.
(4)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
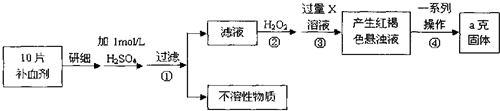
请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:氯水(或双氧水、稀硝酸);溶液由浅绿色变为血红色.
②步骤④中一系列处理的操作步骤:过滤、灼烧、称量.
③若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:
①实验步骤b明显不合理,理由是应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在.
②实验步骤d中用少量冰水洗涤晶体,其目的是洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||

(3)若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃.
(4)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:氯水(或双氧水、稀硝酸);溶液由浅绿色变为血红色.
②步骤④中一系列处理的操作步骤:过滤、灼烧、称量.
③若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
17.把1gNaOH溶于水配制成50mL溶液,所得溶液中NaOH的物质的量浓度为( )
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
4.a L含有硫酸铵和硝酸铵的混合溶液中,加入bmol NaOH并加热,恰好把NH3全部赶出;又加入cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )mol/L.
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
14.下列仪器可以用酒精灯直接加热的是( )
| A. | 试管,烧杯 | B. | 烧瓶,烧杯 | C. | 试管,蒸发皿 | D. | 蒸发皿,量筒 |
1.将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素肯定不是( )
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
18.X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )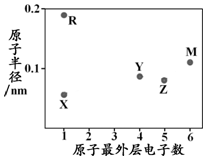

| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
16.为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |