题目内容
10.某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液$\stackrel{滴加KSCN溶液}{→}$无明显现象$\stackrel{滴加氯水}{→}$溶液变红
实验2:0.1mol/L FeCl3溶液$\stackrel{滴加KSCN溶液}{→}$溶液变红$\stackrel{滴加0.1mol/LKI溶液}{→}$溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因2Fe2++Cl2=2Cl-+2Fe3+.
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10mL 0.1mol/L KI溶液$\stackrel{滴加6滴0.1mol/LFeCl_{3}溶液}{→}$溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液$\stackrel{滴加KSCN溶液}{→}$溶液变红
试管2 取3mL黄色溶液$\stackrel{加2滴K_{3}[Fe(CN)_{6}]溶液}{→}$溶液变蓝
试管3 取3mL黄色溶液$\stackrel{加入2mLCCl_{4}}{→}$取上层溶液$\stackrel{加2滴K_{3}[Fe(CN)_{6}]溶液}{→}$溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是Fe2+.
②黄色溶液中含有的溶质微粒有K+、Cl- 和Fe3+、Fe2+、I2.
③综合上述实验现象,得出的实验结论是Fe3+与I-的反应为可逆反应.
分析 (1)Fe(OH)2Cl和盐酸反应生成盐和水;
(2)氯气具有强氧化性,能把亚铁离子氧化生成铁离子;
(3)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
②碘离子和铁离子发生氧化还原反应生成亚铁离子和碘;
③铁离子能使硫氰化钾溶液呈红色,亚铁离子能和铁氰化钾溶液反应生成蓝色沉淀.
解答 解:(1)Fe(OH)2Cl和盐酸反应生成盐和水,离子反应方程式为:Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O,
故答案为:Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O;
(2)氯气具有强氧化性,能被还原性的亚铁离子氧化生成铁离子,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,离子反应方程式为:2Fe2++Cl2=2Cl-+2Fe3+,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;
(3)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,所以试管2中滴加K3[Fe(CN)6]检验的离子是Fe2+,故答案为:Fe2+;
②试管1说明溶液中含有铁离子,试管2说明溶液中含有亚铁离子,铁离子和碘离子反应生成亚铁离子和碘单质,导致溶液中还含有碘单质,所以黄色溶液中含有的溶质微粒有K+、Cl- 和Fe3+、Fe2+、I2,
故答案为:Fe3+、Fe2+、I2;
③碘化钾溶液和少量的氯化铁溶液反应,溶液中存在铁离子和亚铁离子,说明Fe3+与I-的反应为可逆反应,
故答案为:Fe3+与I-的反应为可逆反应.
点评 本题考查了亚铁离子和铁离子之间的相互转化,难度较大,铁离子和亚铁离子的检验是高考的热点,根据铁离子和亚铁离子的特征反应来检验即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.己知常温常压下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量,在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另体积相同的容器中通入0.5molN2和1.5molH2、1molNH3,相同温度下达平衡时放出热量为Q2kJ,则下列叙述正确的是( )
| A. | Q2<Q1<92.4 | B. | 2Q2=Q1=92.4 | C. | Q1<Q2<92.4 | D. | Q2=Q1<92.4 |
2.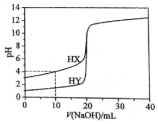 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
19.已知有如下反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |