题目内容
13. 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 总键能/(kJ•mol-1) | 燃烧热/(kJ•mol-1) |
| 金刚石 | a | 395.4 |
| 石墨 | b | 393.5 |
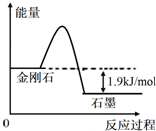
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知a<b | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)═CO(g)△H=-393.5kJ/mol |
分析 由表中的燃烧热可知,①C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ/mol、②C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,②-①得C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,可知金刚石是的能量高,以此来解答.
解答 解:由表中的燃烧热可知,①C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ/mol、②C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,②-①得C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,可知金刚石是的能量高,
A.金刚石转化为石墨为放热反应,可得如右图所示的图象,故A正确;
B.由上述分析可知,C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,故B正确;
C.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则b-a>0,即a<b,故C正确;
D.表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热化学方程式、稳定氧化物及盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意CO不是稳定氧化物,题目难度不大.

练习册系列答案
相关题目
5.(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
8.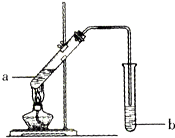 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.
已知下列数据:
(1)写出试管a中主要发生反应的化学方程式CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是:防止倒吸.
(3)试管b中饱和Na2CO3的作用:除去挥发出来的乙酸和乙醇;降低乙酸乙酯的溶解度,有利于分层.
(4)开始用小火加热试管a中的混合液,其原因是乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(5)生成乙酸乙酷的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酷化反应已达到化学平衡状态的有②④⑤(填序号).
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成I mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(6)若120g乙酸和184g乙醇反应生成106g乙酸乙酯,则该反应的产率为60.2%(保留三位有效数字).
 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是:防止倒吸.
(3)试管b中饱和Na2CO3的作用:除去挥发出来的乙酸和乙醇;降低乙酸乙酯的溶解度,有利于分层.
(4)开始用小火加热试管a中的混合液,其原因是乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(5)生成乙酸乙酷的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酷化反应已达到化学平衡状态的有②④⑤(填序号).
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成I mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(6)若120g乙酸和184g乙醇反应生成106g乙酸乙酯,则该反应的产率为60.2%(保留三位有效数字).
2.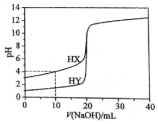 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
3.某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生.下列化合物中符合上述条件的是( )
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
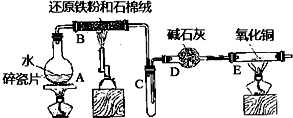
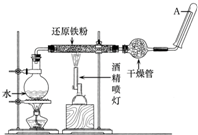 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.