题目内容
8.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的H2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制H2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等.
仪器:①烧杯,②试管,③酒精灯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
(4)请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律.向硅酸钠溶液中加入磷酸溶液,有白色沉淀生成,说明磷酸的酸性比硅酸强,即非金属性:P>Si.
分析 (1)题目的第一句话提示了该实验的目的;
(2)根据实验条件和实验药品的性质判断所需仪器;
(3)镁条能和热水反应生成碱和氢气;氯气具有氧化性能将还原性的硫离子氧化为硫单质;根据实验现象来分析实验的结论;
(4)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,根据最高价含氧酸的制备来分析.
解答 解(1)因题干提示信息:某同学做同周期元素性质递变规律实验时,设计了一套实验方案,可知实验目的是探究同周期元素性质的递变规律,
故答案为:同周期;
(2)该试验加水加热至沸腾,则需要酒精灯,钠与水反应的实验应在烧杯中进行,溶液之间反应的反应一般在试管中进行,
故答案为:烧杯;试管;酒精灯;
(3)①因镁条能和热水反应生成氢氧化镁和氢气,氢氧化镁是碱,遇酚酞变红,所以会看到镁条表面有大量气泡,溶液变成红色,反应为:Mg+2H2O=Mg(OH)2+H2↑,
②因氯气能将硫离子氧化为硫:Na2S+Cl2=2NaCl+S↓,硫不溶于水,为淡黄色,所以溶液中产生浅黄色沉淀;
③因钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠,氢氧化钠遇酚酞变红,同时反应放热,所以钠浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
④因镁为活泼金属,与盐酸发生置换反应,所以剧烈反应,迅速产生大量无色气体;
⑤铝能与盐酸反应,较镁不活泼,所以反应不十分剧烈;产生无色气体;
⑥A1Cl3与NaOH反应生成A1(OH)3,A1(OH)3具有两性,能与NaOH反应生成可溶于水的偏铝酸钠,所以先生成白色胶状沉淀,继而沉淀消失,
由实验可知:金属性Na>Mg>Al,非金属性Cl>S,则同一周期元素从左到右,金属性减弱,非金属性增强;
故答案为:
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | B | F | A | C | D | E |
(4)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,向硅酸钠溶液中加入磷酸溶液,有白色沉淀生成,说明磷酸的酸性比硅酸强,即非金属性:P>Si;
故答案为:向硅酸钠溶液中加入磷酸溶液,有白色沉淀生成,说明磷酸的酸性比硅酸强,即非金属性:P>Si.
点评 本题考查同周期元素性质递变规律,题目难度中等,注意物质的性质以及元素周期律的递变规律,培养了学生分析和解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 酒精和水 | B. | 食盐和水 | C. | 酱油和汽油 | D. | 芝麻和黄豆 |
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
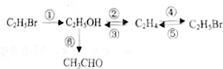
 ②CH3CH2OH
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O CH3CH2Br 乙醛的银镜反应
CH3CH2Br 乙醛的银镜反应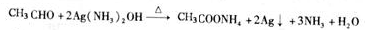
 .
.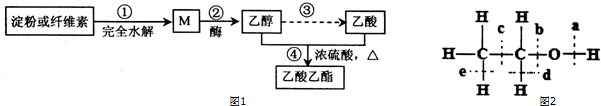
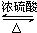 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.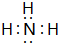 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为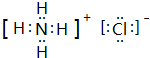 .
.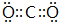 .z单质的电子式为
.z单质的电子式为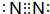 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为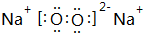 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.