题目内容
10.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: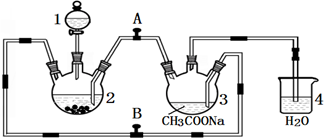
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
(1)仪器1的名称是分液漏斗.
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是C(选下面的A、B或C);目的是让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化.
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门B(填“A”或“B”,下同),打开阀门A.
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是使锌与CrCl3充分反应得到CrCl2.
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.48g,则该实验所得产品的产率为84.0%(不考虑溶解的醋酸亚铬水合物).
分析 (1)根据仪器结构特征,可知仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率.
解答 解:(1)根据仪器结构特征,可知仪器1为分液漏斗,
故答案为:分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
故答案为:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
故答案为:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,
故答案为:使锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为$\frac{9.51g}{158.5g/mol}$=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)可知CH3COONa足量,则得到[Cr(CH3COO)2]2•2H2O为0.06mol×$\frac{1}{2}$×376g/mol=11.28g,
所得产品的产率为:$\frac{9.48g}{11.28g}$×100%=84.0%,
故答案为:84.0%.
点评 本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力.

| A. | 氢氧化钠和葡萄糖分别溶解在水中 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 食盐和冰分别受热熔化 | D. | 液溴和酒精分别挥发 |
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1CuSO4 溶液 | 将25.0gCuSO4•5H2O溶于蒸馏水配成100mL溶液 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液是否含有SO42- | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 该物质苯环上的三氯代物有 4 种 | |
| B. | 1 mol 该物质和 H2加成最多需要H2的物质的量为 2 mol | |
| C. | 能使溴水褪色,1 mol 该物质和溴水混合,最多消耗 Br2的物质的量为 5 mol | |
| D. | 该物质难溶于水,能使酸性高锰酸钾溶液褪色,且发生的是加成反应 |
| A. | CO和N2 | B. | N2H4 和C2H4 | C. | CO2和N2O | D. | O3和SO2 |
| A. | 2-二甲基-3-乙基丁烷 | B. | 2,2,3-三甲基戊烷 | ||
| C. | 2,2-二甲基-3-乙基丁烷 | D. | 3,4,4-三甲基戊烷 |
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 食用油和汽油都属于酯类,都能用来工业上制肥皂 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 地沟油若被回收重新流入餐桌,对人体伤害极大,应倡导加工处理生成生物柴油 |
| A. | 1molCl2参加反应转移电子数不一定为2NA | |
| B. | 在16g18O2中含有10NA个中子 | |
| C. | 标准状况下,22.4L HF中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
 .
. .
.