题目内容
19.下列有关化学与生活的叙述错误的是( )| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 食用油和汽油都属于酯类,都能用来工业上制肥皂 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 地沟油若被回收重新流入餐桌,对人体伤害极大,应倡导加工处理生成生物柴油 |
分析 A.利用太阳能、潮汐能、风力发电,无污染产生,
B.汽油是多种烃的混合物;
C.白色污染与塑料有关,难以降解;
D.将地沟油回收加工为生物柴油,可以变废为宝.
解答 解:A.利用太阳能、潮汐能、风力发电,不会对环境造成污染,为清洁能源,故A正确;
B.汽油是多种烃的混合物,不属于酯类,故B错误;
C.塑料难以降解,所以利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染,故C正确;
D.地沟油是一种质量极差、极不卫生的非食用油,将地沟油回收加工为生物柴油,可以提高资源的利用率,故D正确;
故选B.
点评 本题考查环境污染、能源与生活,把握常见的环境污染问题及物质的性质为解答的关键,难度不大.

练习册系列答案
相关题目
7.下列有关物质的性质与应用不相对应的是( )
| A. | 铝的熔点很高,可用于制作耐高温材料 | |
| B. | Na2O2能与水和二氧化碳反应生成氧气,可用于呼吸面具中作为氧气的来源 | |
| C. | 明矾能在天然水中生成Al(OH)3胶体,可用作净水剂 | |
| D. | 用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
14.若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子“的变化.在变化的各阶段被破坏的粒子间主要的相互作用是( )
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;非极性键 | ||
| C. | 氢键;极性键;分子间作用力 | D. | 分子间作用力;氢键;非极性键 |
4.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO3-、Cl- | |
| C. | pH=7的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
11.电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物.其工业制取流程如图1:
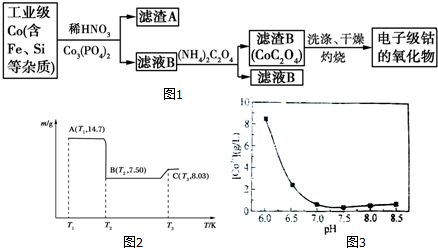
(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
b.CoSO4与NH4HCO3反应时,母液中钴离子含量与溶液pH关系图如图3:
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.
9.某小组同学按图所示流程进行实验,用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,请你参与讨论并回答相关问题.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
【反思与评价】根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀硫酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 | 猜想成立 |
 .
. .
. .
.