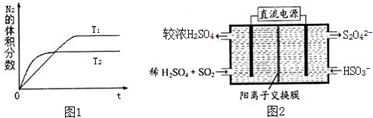
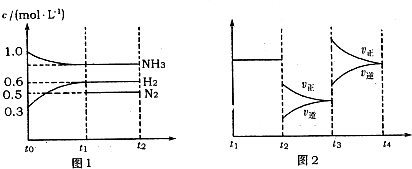
题目内容
1.下列操作不能达到目的是( )| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1CuSO4 溶液 | 将25.0gCuSO4•5H2O溶于蒸馏水配成100mL溶液 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液是否含有SO42- | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水的体积不等于溶液的体积;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离;
C.硝酸能将亚硫酸根氧化为硫酸根;
D.NH4+可与碱反应生成氨气.
解答 解:A.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故A正确;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离,故B正确;
C.硝酸有强氧化性,硝酸能将亚硫酸根氧化为硫酸根,故C错误;
D.NH4+可与碱反应生成氨气,氨气为碱性气体,可使红色湿润的石蕊试纸变蓝,故D正确.
故选C.
点评 本题考查化学实验方案的评价,涉及物质的分离、检验和溶液的配制等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的合理性和可行性的评价,难度不大.

练习册系列答案
相关题目
11.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |
6.下列反应过程中的能量变化与如图一致的是( )
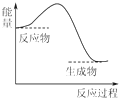

| A. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
13.下列有关实验操作、现象和结论都正确的是( )
| 实验操作 | 现象和结论 | |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量KCl溶液 | 溶液红色变浅,平衡逆向移动 |
| B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
| C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
11.电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物.其工业制取流程如图1:
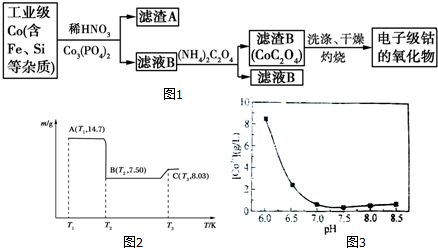
(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
b.CoSO4与NH4HCO3反应时,母液中钴离子含量与溶液pH关系图如图3:
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.