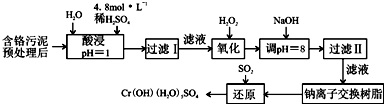
题目内容
在一定温度下,反应AB(g)?
A2(g)+
B2(g)的平衡常数为0.1.若将1.0mol的AB(g)通入体积为1.0L的密闭容器中,在该温度时AB(g)的最大分解率接近于( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、5% | B、17% |
| C、25% | D、33% |
考点:化学平衡的计算
专题:化学平衡专题
分析:由一定温度下,反应AB(g)?
H2(g)+
B2(g)的平衡常数为0.1,设出AB分解的物质的量,利用化学平衡三段法来计算各物质平衡时的浓度,然后利用平衡常数为0.1来计算解答.
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:设HX分解的物质的量为x,则
AB(g)?
H2(g)+
B2(g)
开始 1.0mol/L 0 0
转化
mol/L
mol/L
mol/L
平衡 (1-x)mol/L
mol/L
mol/L
故
=0.1
解得x=0.17mol,
该温度时HX(g)的最大分解率为
×100%=17%,
故选B.
AB(g)?
| 1 |
| 2 |
| 1 |
| 2 |
开始 1.0mol/L 0 0
转化
| x |
| 1 |
| x |
| 2 |
| x |
| 2 |
平衡 (1-x)mol/L
| x |
| 2 |
| x |
| 2 |
故
| ||||||||
| 1-x |
解得x=0.17mol,
该温度时HX(g)的最大分解率为
| 0.17mol |
| 1.0mol |
故选B.
点评:本题考查学生利用平衡常数的计算,学生应熟悉化学平衡三段法计算的格式及步骤来解答.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列说法正确的是( )
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
下列解释事实的离子方程式正确的是( )
| A、金属铝溶于氢氧化钠溶液:Al+2OH-+2H2O=[Al(OH)4]-+H2↑ |
| B、过量铁溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
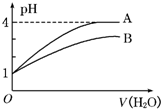 常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )| A、A酸比B酸的电离程度小 |
| B、pH=1时,B酸的物质的量浓度比A酸大 |
| C、B酸比A酸容易电离 |
| D、A是强碱,B是弱碱 |
常温下,浓度均为0.1mol?L-1的6种盐溶液pH如下,下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
| A、电离能力:HCO3->HSO3->HClO |
| B、结合H+的能力:SiO32->CO32->SO32- |
| C、6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D、若要增大新制饱和氯水中HClO的浓度,可向其中加入Na2SiO3或Na2SO3 |