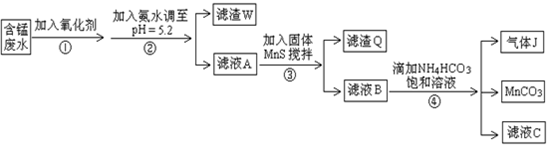
题目内容
明矾石热料是制取氢氧化铝和钾肥的重要原料,明矾石热料含有Al2(SO4)3、K2SO4和少量氧化铁杂质.实验步骤如下:

(1)操作①为 .操作②的主要目的是 .
(2)溶解步骤中,发生反应的离子方程式为 .
(3)沉淀物的主要成分是 .
(4)沉淀物加入NaOH溶液,发生反应的离子方程式为 .
(5)无色溶液A中除K+、NH4+外,还有SO42-,检验溶液中存在SO42-的实验步骤是取少量无色溶液A于试管中 .

(1)操作①为
(2)溶解步骤中,发生反应的离子方程式为
(3)沉淀物的主要成分是
(4)沉淀物加入NaOH溶液,发生反应的离子方程式为
(5)无色溶液A中除K+、NH4+外,还有SO42-,检验溶液中存在SO42-的实验步骤是取少量无色溶液A于试管中
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:明矾石热料含有Al2(SO4)3、K2SO4和少量氧化铁杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子、铵根离子,则无色溶液通过蒸发结晶过滤得到得到硫酸钾和硫酸铵作化肥,Fe2O3、Al(OH)3中氢氧化铝溶于氢氧化钠生成偏铝酸钠,氧化铁不反应,过滤后向滤液中通二氧化碳可得到氢氧化铝沉淀.
(1)难溶物和溶液分开采取过滤的方法,通过操作2把氧化铁和偏铝酸钠溶液分开;
(2)明矾石加入足量的稀氨水中浸出时,铝离子和氨水反应生成氢氧化铝沉淀;
(3)氧化铁不溶于氨水,铝离子与氨水反应生成沉淀;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(5)按检验SO42-的步骤解答.
(1)难溶物和溶液分开采取过滤的方法,通过操作2把氧化铁和偏铝酸钠溶液分开;
(2)明矾石加入足量的稀氨水中浸出时,铝离子和氨水反应生成氢氧化铝沉淀;
(3)氧化铁不溶于氨水,铝离子与氨水反应生成沉淀;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(5)按检验SO42-的步骤解答.
解答:
解:明矾石热料含有Al2(SO4)3、K2SO4和少量氧化铁杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子、铵根离子,则无色溶液通过蒸发结晶过滤得到得到硫酸钾和硫酸铵作化肥,Fe2O3、Al(OH)3中氢氧化铝溶于氢氧化钠生成偏铝酸钠,氧化铁不反应,过滤后向滤液中通二氧化碳可得到氢氧化铝沉淀.
(1)难溶物和溶液分开采取过滤的方法,通过操作2把氧化铁和偏铝酸钠溶液分开,故答案为:过滤;把氧化铁和偏铝酸钠溶液分开;
(2)明矾石加入足量的稀氨水中浸出时,铝离子和氨水反应生成氢氧化铝沉淀,发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(3)氧化铁不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Fe2O3、Al(OH)3,故答案为:Fe2O3、Al(OH)3;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)检验溶液中存在SO42-,一般是先加入盐酸无现象,再加入氯化钡,若生成白色硫酸钡沉淀,证明含硫酸根离子,
故答案为:先加入盐酸无现象,再加入氯化钡,若生成白色硫酸钡沉淀,证明含硫酸根离子.
(1)难溶物和溶液分开采取过滤的方法,通过操作2把氧化铁和偏铝酸钠溶液分开,故答案为:过滤;把氧化铁和偏铝酸钠溶液分开;
(2)明矾石加入足量的稀氨水中浸出时,铝离子和氨水反应生成氢氧化铝沉淀,发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(3)氧化铁不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Fe2O3、Al(OH)3,故答案为:Fe2O3、Al(OH)3;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)检验溶液中存在SO42-,一般是先加入盐酸无现象,再加入氯化钡,若生成白色硫酸钡沉淀,证明含硫酸根离子,
故答案为:先加入盐酸无现象,再加入氯化钡,若生成白色硫酸钡沉淀,证明含硫酸根离子.
点评:本题考查较综合,涉及物质制备实验方案的设计,把握实验流程中发生的反应及分离方法为解答的关键,侧重分析能力及迁移应用能力的考查,题目难度中等.注意铝及其化合物的性质.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
下列各组有机物中,只用一种试剂无法鉴别的是( )
| A、苯、苯酚、己烯 |
| B、苯、甲苯、乙苯 |
| C、乙醇、甲苯、硝基苯 |
| D、乙醇、乙醛、乙酸 |
在一定温度下,反应AB(g)?
A2(g)+
B2(g)的平衡常数为0.1.若将1.0mol的AB(g)通入体积为1.0L的密闭容器中,在该温度时AB(g)的最大分解率接近于( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、5% | B、17% |
| C、25% | D、33% |
下列卤代烃中,既能发生取代反应又能发生消去反应的是( )
| A、CH3Cl |
| B、CH3CH2CH2Br |
C、 |
D、 |
要想使AlCl3溶液中的Al3+全部沉淀下来,应选用下列试剂中的( )
| A、石灰水 | B、氢氧化钠溶液 |
| C、硫酸 | D、氨水 |