题目内容
铬及其化合物在现代工业上的应用广泛,可用于电镀,鞣制羊毛,皮革;铬还用于照相材料,胶版印刷及化工触媒剂等.但化工废料铬渣对人体健康有很大危害.
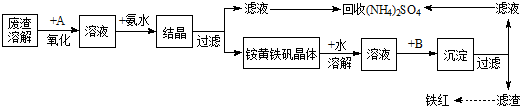
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
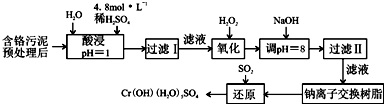
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol?L-1的浓硫酸配制250mL 4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 .
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点).
(3)调节溶液的pH=8是为了除去 离子.钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是 .
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 .
(5)还原过程发生以下反应(请配平): Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.用Fe做电极的原因为 ,在阴极附近溶液pH升高的原因是(用电极反应解释) .
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)酸浸时,为了提高浸取率可采取的措施是
(3)调节溶液的pH=8是为了除去
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
(5)还原过程发生以下反应(请配平):
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.用Fe做电极的原因为
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应方程式的配平,难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:实验设计题,基本概念与基本理论
分析:I.(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;钠离子交换树脂交换的离子是钙离子和镁离子;
(4)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH;
(5)根据二氧化硫的还原性和Na2Cr2O7的氧化性,利用氧化还原反应原理分析书写;
II.阳极是活性电极时,阳极本身失电子,生成阳离子,亚铁离子能还原Cr2O72-;电解时阴极上氢离子得电子.
(2)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;钠离子交换树脂交换的离子是钙离子和镁离子;
(4)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH;
(5)根据二氧化硫的还原性和Na2Cr2O7的氧化性,利用氧化还原反应原理分析书写;
II.阳极是活性电极时,阳极本身失电子,生成阳离子,亚铁离子能还原Cr2O72-;电解时阴极上氢离子得电子.
解答:
解:I.(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:升高反应温度、增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;钠离子交换树脂交换的离子是钙离子和镁离子;
故答案为:Fe3+、Al3+;Ca2+、Mg2+;
(4)根据溶度积常数得溶液中c(OH-)=
=
mol/L=10-9 mol/L,则溶液中氢离子浓度=
mol/L=10-5 mol/L,则溶液的pH=5,
故答案为:5;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;Na2CrO4+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1;3;11;H2O;2;1;
II.阳极是活性电极时,阳极本身失电子,生成阳离子,阳极反应为Fe-2e-=Fe2+,亚铁离子能还原Cr2O72-;电解时阴极上氢离子得电子,则阴极上电极方程为:2H++2e-=H2↑,溶液中氢离子浓度减小,pH增大;
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;2H++2e-=H2↑.
(2)酸浸时,为了提高浸取率可采取的措施是:升高反应温度、增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;钠离子交换树脂交换的离子是钙离子和镁离子;
故答案为:Fe3+、Al3+;Ca2+、Mg2+;
(4)根据溶度积常数得溶液中c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-9 |
故答案为:5;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;Na2CrO4+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,
故答案为:1;3;11;H2O;2;1;
II.阳极是活性电极时,阳极本身失电子,生成阳离子,阳极反应为Fe-2e-=Fe2+,亚铁离子能还原Cr2O72-;电解时阴极上氢离子得电子,则阴极上电极方程为:2H++2e-=H2↑,溶液中氢离子浓度减小,pH增大;
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;2H++2e-=H2↑.
点评:本题考查了溶液配制、化学方程式的配平、物质的分离、Ksp的有关计算、电解原理的应用等知识点,题目难度较大,注意会运用溶液pH值的调节对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有以下物质,①NaCl晶体 ②蔗糖晶体 ③纯醋酸 ④铁 ⑤硫酸钡晶体 ⑥SO2 ⑦CH4 ⑧熔化的KNO3,⑨稀硫酸,⑩KOH溶液.这些物质中(填序号):其中,属于电解质的是 ,属于非电解质的是 .
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |