题目内容
下列解释事实的离子方程式正确的是( )
| A、金属铝溶于氢氧化钠溶液:Al+2OH-+2H2O=[Al(OH)4]-+H2↑ |
| B、过量铁溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.该氧化还原反应中得失电子不相等,违反了电子守恒;
B.铁粉过量,反应生成亚铁离子,不是生成铁离子;
C.醋酸和碳酸钙在离子方程式中都需要保留化学式;
D.氢氧化钠少量,离子方程式按照氢氧化钠的化学式中性书写.
B.铁粉过量,反应生成亚铁离子,不是生成铁离子;
C.醋酸和碳酸钙在离子方程式中都需要保留化学式;
D.氢氧化钠少量,离子方程式按照氢氧化钠的化学式中性书写.
解答:
解:A.金属铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故A错误;
B.过量铁溶于稀硝酸,反应生成硝酸亚铁,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.用食醋除去暖水瓶中的水垢,反应的离子方程式为:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O,故C正确;
D.氢氧化钠少量,反应生成碳酸钙沉淀,产物中不会有剩余的碳酸根离子,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误;
故选C.
B.过量铁溶于稀硝酸,反应生成硝酸亚铁,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.用食醋除去暖水瓶中的水垢,反应的离子方程式为:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O,故C正确;
D.氢氧化钠少量,反应生成碳酸钙沉淀,产物中不会有剩余的碳酸根离子,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
A、 检查装置气密性 |
B、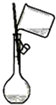 向容量瓶中转移液体 |
C、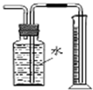 测量Cu与浓硝酸产生气体体积 |
D、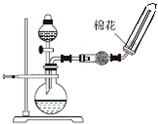 实验室制取并收集NH3 |
在一定温度下,反应AB(g)?
A2(g)+
B2(g)的平衡常数为0.1.若将1.0mol的AB(g)通入体积为1.0L的密闭容器中,在该温度时AB(g)的最大分解率接近于( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、5% | B、17% |
| C、25% | D、33% |
以下分离混合物的操作中,不正确的是( )
A、蒸发时,蒸发皿内所盛液体不超过蒸发皿容积的
| ||
| B、蒸发结晶时,不能直接蒸干液体,最后少量液体用余热蒸干 | ||
| C、用四氯化碳萃取碘水中的碘,分液时四氯化碳碘溶液从上口倒出 | ||
| D、蒸馏时,要在烧瓶中加入几粒碎瓷片 |
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色.将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列说法不正确的是( )
| A、①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失 |
| B、[Fe(SCN)]2+中Fe3+与SCN-以配位键结合 |
| C、②红色褪去的原因是SO2具有还原性 |
| D、SCN-在适当条件下可被还原为(SCN)2 |

 分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )
分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )